Mass spectrometry
(2)ESI:Electrospray ionization(電灑法;電噴霧離子化)
(1.) 傳統Mass analyzer (僅適用於小分子)
(2.)Time-of-flight Analyzers (TOF)
(5.)Fourier transform ion cyclotron (FT-ICR)
(2) 二次電子增幅器 (Secondary electron multiplier, SEM)
(3) 微通道盤 (Micro Channel Plate, MCP)
(4) 達利偵測器 (Daly detector, 又名光電增幅器, Photomultiplier)
(2.) MALDI-TOF在研究peptide序列及鑑定各種蛋白質的應用
(2)ESI-triple quadrupole與ESI-Q-TOP
蛋白質體學 (proteomics),顧名思義為一門研究蛋白質體 (Proteome),即有關蛋白質的鑑定、生化特性以及結構分析的科學。然而,隨著各項分析技術的突破與基因體資訊的快速建立及日益完備,今日「蛋白質體學」一詞幾乎包括了所有後基因體的 (Post-genomic) 研究,除了基礎的蛋白質鑑定、生化特性與結構分析,更延伸到蛋白質之間的交互作用、蛋白質生物功能的複雜網絡之建立以及動態的蛋白質表現 (expression) 之系統化探討皆屬其研究範圍[8]。
蛋白質體學之所以能夠快速地發展成為如此複雜且龐大的一門科學,除了因為是建構在愈趨龐大與完整的基因體資料庫之外,蛋白質分析技術的突破加上快速累積與發展的生物資訊學 (Bioinfomatics),利用高速電腦搭配各種相關資料庫進行蛋白質的結構運算與模擬、生物功能的預測與系統化分析等等,使得蛋白質體學成為目前最重大的研究課題與領域之一。
在蛋白質體學中,最基本也是最重要的研究方法就是快速的蛋白質分析與鑑定。在分析方面,二維電泳 (Two-dimensional electrophoresis) 以及毛細管電泳等分析技術的突飛猛進,使得我們擁有「親眼目睹」蛋白質的複雜與龐大的能力。對於蛋白質的「鑑定」,早期的方法是利用高效能液相層析儀 (High Performance Liquid Chromatography, HPLC) 或是二維電泳先將目標物中的各個組成蛋白質,進行分析與分離之後再以Edman sequencing進行N端胺基酸序列分析,或是將分離所得之蛋白質先經過特定蛋白質水解酵素進行水解後的胜肽片段 (peptide fragments) 進行Edman sequencing,最後經由所得之胺基酸序列組合來鑑定標的蛋白質。然而利用這種方式所花費的時間較長,從目標物組成的分析與分離到酵素水解與Edman sequencing,一星期大概只能解讀出三、四個胜肽片段的胺基酸序列。因此,這些傳統的鑑定方法是無法應用現今如此龐大而複雜的蛋白質體研究。然而質譜 (Mass spectrometry, MS) 技術的突破,讓蛋白質體的研究不再是難以實現的夢想。
蛋白質是由二十種胺基酸分子所組成,每個蛋白質都具有特定的胺基酸數目與排列順序。早在1984年Biemann等人[6]就提出利用這個特性,以蛋白質水解酵素 (如Trypsin) 針對蛋白質分子中特定的胺基酸 (如Arginine及Lysine) 進行水解,每一個蛋白質將被切割成一群獨特、大小不同、質量不一的胜肽片段。理論上,每一個不同的蛋白質都會對應到唯一的一群胜肽片段組合,亦即一群特別的質量數組合,就如同每一個人都擁有不同的指紋一樣,具有獨特性且重覆的機會非常小,也因此這一群特別的胜肽質量數組合便稱之為蛋白質的「胜肽質量指紋 (Peptide-mass fingerprinting, PMF)」,於是我們就可以利用這樣的方式進行快速的蛋白質鑑定。
隨著各物種的基因資料庫越來越完備的情況下,每一個基因所轉譯的蛋白質胺基酸序列,及其經由各種蛋白脢切割後成所形成胜肽片段的質量數組合,皆可以利用生物資訊學加以分析與預測,並且建立共享的生物資訊電子資料庫,讓所有的蛋白質體研究者得以快速地從網路上獲得最新與最完整的相關資訊。舉例來說,在二維電泳膠片上所分離之上千種蛋白質,可以分別取出並利用蛋白脢切割成胜肽片段,接著利用質譜儀分析出這些胜肽片段的質量數組合,直接將這些胜肽質量數組合輸入電子資料庫比對,即可完成蛋白質的鑑定。因此,如何擴大質譜儀對於生物性材料的應用範圍以及提昇其靈敏度、解析力與效率,便成為加速蛋白質體學研究腳步的關鍵課題之一。
早期質譜儀的應用侷限於較小的化學分子之定性及定量,主要是因為在開始進行質譜分析之前,必須先將分析物離子化 (ionization)。傳統上多使用加熱的方式將分析物氣化後再離子化,然而以加熱氣化的方式進行高極性分子的離子化時,易發生熱裂解的現象,蛋白質分子多屬高極性分子且分子量大 (10,000 ~ 300,000 Dalton, Da),因此無法以此方式進行分析。為了克服極性分子熱烈解現象所帶來的限制,許多的離子化方法不斷地被研究出來,「快速原子撞擊法(Fast Atom Bombardment, FAB)」便是其中之一。FAB是由英國的巴柏教授所開發出來,其原理是先將分析物溶於適當的介質中,再使用高能的原子撞擊樣品,便可有效的解決高極性分子離子化的過程。然而,應用FAB離子化分子量超過3,000 Da的分子時,離子化的效率將下降非常快,因此只能應用於小分子量的胜肽,對於分子量一萬以上的蛋白質仍無法以FAB-MS加以分析。
80年代中,電漿脫附法 (Plasma Desorption, PD) 的出現,將質譜儀能分析的分子量範圍提升到了45,000,使蛋白質進行質譜分析成為可能。此法主要是使用放射性元素鉲 (Cf) 252裂解後所產生的高能粒子,撞擊配製於硝化纖維 (nitrocellulose) 中的生化分子,使之產生離子化現象。PD-MS分析蛋白質的能力雖優於FAB-MS,但欲以此法得到一張質譜圖,往往需要幾個小時或更長的時間,因此PD-MS在分析蛋白質的效率上及分子量範圍上仍不敷所需。
到了1988年以質譜方式分析蛋白質的瓶頸有了突破性的發展,兩種嶄新而有效的離子化方法在同一年被開發出來並因而得到2002年的諾貝爾化學獎,第一個是美國的芬恩教授 (John B. Fenn) 所提出的電灑法 (eletrospray Ionozation, ESI),另一個是日本的Koichi Tanaka (田中耕一) 先生所開發的軟雷射揮離法 (Soft Laser Desorption Ionization, SLDI)。其中,尚有一位Hillemkamp教授也於同年發表類似的雷射離子化蛋白質方法,稱之為基質輔助雷射脫附游離法 (Matrix Assisted Laser Desorption Ionization, MALDI)。雖然Hillemkamp教授的MALDI未獲得諾貝爾獎的殊榮,但是MALDI與ESI這兩大技術分別提供了一個快速而有效率方法進行蛋白質與其他大分子生物物質的質譜分析,也因此加速了蛋白質體學的發展。
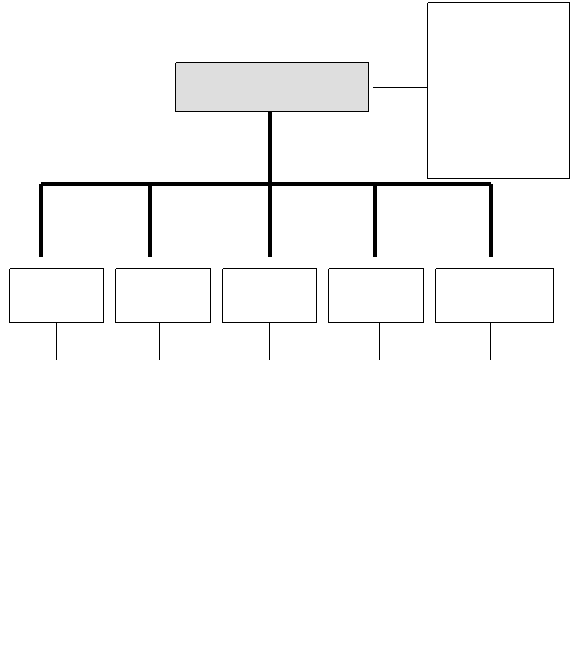
![]() 質譜儀的主要可以分為五部分
(如圖1所示),各組成之間的分析流程如圖2所示,以下將分別對質譜儀的各組成部份之原理與功能作更進一步的說明與討論。
質譜儀的主要可以分為五部分
(如圖1所示),各組成之間的分析流程如圖2所示,以下將分別對質譜儀的各組成部份之原理與功能作更進一步的說明與討論。
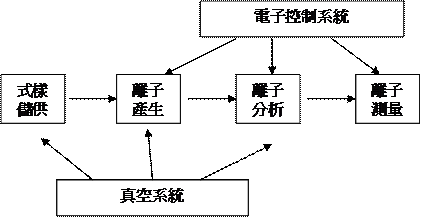
圖2:質譜儀的分析流程
主要功能是將蛋白質樣品送入機器中。在送入機器之前,這些蛋白質樣品可以先經過純化、分離、或是以蛋白質水解脢水解成胜肽片段。進樣系統負責將樣品送入離子源,而不同狀態之樣品(氣、液或固相)需要不同的進樣系統。
進行質譜分析之前,首先要做的就是樣品之離子化 (ionization) 過程,也就是將分析樣品經處理過後轉變成氣相的帶電離子。以下將分早期的傳統游離法以及現在最常用的現代游離法分別進行介紹。
(1) 電子撞擊游離法 (Electron-impact Ionization, EI)
是利用直熱式陰極發射的電子去轟擊氣體狀態的分子或原子,使樣品分子產生離子化的現象。EI源具有以下優缺點:要求被分析樣品具有一定的揮發性;有些類型的化合物在EI源中得不到分子離子峰;產生的碎片離子多,有利於結構分析。EI源適用於氣體和易揮發的固體試樣,對非揮發和難揮發的試樣分析困難。
(2) 化學游離法 (Chemical Ionization, CI)
是通過分子-離子反應使樣品離子化的方法,離子化過程中需要反應氣體。利用CI所得到的離子多數是準分子離子,即 (M+H)+,分子斷裂的碎片較少,有利於測定化合物的分子量,但較不利於化合物的結構解析。
(3) 場脫附法(Field Desorption Ionization, FD)
採用強電場使樣品分子或原子不經氣化的過程而直接被離子化,所得到的多是M+.或 (M+H)+ 的樣品離子,當有痕量鹽存在時可以生成複合離子,如 (M+Na)+ 與 (M+K) +等。適用於難揮發和熱不穩定的化合物分子量之測定。
(4) 快速原子撞擊法 (Fast Atom Bombardment, FAB)
利用快速高能原子轟擊加在底物(常用甘油)中的樣品分子使其電離。得到的是準分子離子 (M+H)+。當有金屬鹽存在時可以生成(M+Na)+ 與 (M+K) +等,同時可得到一些碎片離子,對於解析樣品結構有一定的幫助。FAB源適合於分析熱不穩定、難揮發和強極性的化合物。本儀器使用碘化銫槍,靈敏度優於氬槍。
(5) 雷射脫附游離法 (Laser Desorption Ionization , LD)
是新近發展起來的一種有效離子化技術,能量高、指向性強,因此具有其他能源難以達到的離子化成效,可獲得很強的準分子離子。
(6)大氣壓化學游離法 (Atmospheric Pressure Chemical Ionization, APCI)
是將化學電離原理延伸到大氣壓下進行的電離方法。主要是分析中等極性以上的化合物,常用於分析藥物及代謝產物的分析等。
(8) 場游離法 (Field Ionization, FI)
適用於非常易變分子的離子化,如碳水化合物、氨基酸、多胜肽、抗生素和苯丙胺類藥物均宜採用;此法也能產生較強的分子離子和準分子離子峰。
這裡所指的現代游離法主要是指前述1980年代末發明的兩種離子化技術,一種是基質輔助雷射脫附離子化法 (MALDI),以及另一種電灑離子化法 (ESI)。這些離子化技術能快速而有效率地幫助高分子量的生物性分子離子化,而得以進行質譜分析。
基質輔助雷射脫附法,主要是由傳統的雷射脫附法 (LD) 改良而來。雷射在早期質譜技術上的運用,是將一強而短的雷射脈衝直接照射在樣品上,樣品吸收了紫外光或是紅外光,導致電子的 (electronic) 或是振動的 (vibrational) 激發而揮發及離子化。這一技術稱為直接雷射脫附游離法,但由於能量直接轉移使得分子揮發游離的同時也會產生樣品分子的解離,傳統的雷射脫附法於1960年代就已被提出,於1978年波薩瑪斯 (M. A. Posthumus) 等人就已應用於核苷酸、胺基酸、醣類等較小的生化分子的研究,其方法是將高能量的雷射光束照射在固體表面上,可從表面脫附出完整的離子,再進行質譜分析。由於雷射的能量很高,易將欲分析的化合物打成許多的離子碎片,而使得質譜圖上出現較多的雜訊,若將分子量較大的樣本加以分析,會因雜訊的干擾過大,而無法進行分析。
基於上述的限制,此一方法只能應用在低分子量的樣品分析上。一般的生物分子質量極限約為1000 Da而合成高分子則為9000 Da左右,這個限制在基質的使用後已被突破。新發展出的技術是將樣品跟液體或是固體基質的溶液相混和,分析物對基質的莫爾數比在1:100到1:50,000之間,基質的選擇必須要能吸收雷射波長並具有類似分析物的溶解特性。使用基質的目的是要將雷射能量間接的轉移到分析物上以避免其解離,所以此技術稱為介質輔助雷射脫附游離法。
1987年9月,田中耕一於Takerazuka舉行的「中 (大陸) 日雙邊質譜研討會」中發表了使用軟雷射揮離法 (SLDI) 進行分子量為34529 的carboxypeptidase質譜分析結果,成功地分析一完整的蛋白質分子的圖譜,這是以LD為基礎並以顆粒大小約300埃[a]的鈷金屬粉末與甘油混合的兩相系統做為分析蛋白質之介質,利用波長337奈米[b] (nm)的氮雷射進行脫附游離的介質輔助離子脫附技術,對於利用質譜分析大分子量物質是一次重大的突破,田中耕一先生也因此獲得2002年的諾貝爾化學獎。但是現今所最常使用的基質輔助輔助雷射脫附游離法 (MALDI) ,指的卻是1988年另一位德國的Hillenkamp教授所發展出來的技術。MALDI的靈敏度比起SLDI高了兩個數量級 (order),因此對於必須經常分析微量樣品的蛋白質體學而言,SLDI的應用性比起MALDI是相去甚遠,也因此今日的介質輔助離子脫附技術幾乎都是以MALDI為最主要的技術。
MALDI與傳統LD的最大不同處在於離子化時樣本處理的方式,一般來說,MALDI在進行樣品的離子化時,是先將分析樣本與小分子量的有機分子 (具有高度吸收雷射能量特性) 基質加以混合,然後再將大約1μl的樣品—基質混合物點至於平滑的金屬樣品托盤 (sample plate) 表面上,待其乾燥形成固體結晶後,經過進樣系統送入質譜儀之離子源中施以雷射脈衝,基質可將所吸收的能量轉移給樣本分子,並透過高電壓作用使之游離為氣相離子3。由於基質的輔助,可將需要離子化大蛋白的雷射能量降低,可有效避免先前因雷射源太強使得欲分析的樣本斷為多個片段,而使雜訊過大的困擾。
基質輔助雷射脫附-飛行時間質譜法 (MALDI-time of flight, TOF), 即為結合基質輔助雷射脫附離子化技術與飛行時間質譜分析的應用。MALDI採用短的脈衝鐳射 (1~10 ns) 與高電壓使樣品分子離子化並加速之後進入飛行管後以進行質譜儀分析。將處於固相或粘稠的液相狀態樣品與基質的混和物經由雷射脈衝的撞擊,激發基質分子並將能量與電荷轉移至樣品分子,樣品分子接受能量與電荷之後使得接近表面的分子相斥分離,釋出帶電的氣態離子,然後藉由電場加速後進入飛行管中進行自由飛行 (free flight),透過其飛行時間的長短可得到其精確的質荷比 (m/z)。現今尚有多種以基質輔助雷射脫附技術為基礎所發展的游離法,例如表面輔助雷射脫附游離法 (Surface assisted Laser Desorption Ionization, SALDI)、以及矽材表面直接游離 (Desorption Ionization On porous Silicon, DIOS) 等方法都是。

圖3:Bruker OmniFLEX MALDI/TOF MS
此質譜儀屬於時間飛行時間式質譜儀,具有直線式偵測器以及反射式偵測兩種操作模式。在直線操作模式中解析度約在3,000,而在反射式的操作模式中可以達到10,000 (視分析物的分子量而有所不同)。
目前常見的MALDI是以雷射光脈衝照射在固定於平面電極上的蛋白質與基質的混合物,經由平行電場加速再由質量分析單元中進行分析。如圖4所示,以波長337nm的氮氣雷射光脈衝 (此波長不會被蛋白質中的芳香環狀分子所吸收,避免蛋白質碎裂) 擊打固定於基質 (matrix) 上的蛋白質分子,使得蛋白質從基質上游離並帶上微弱的正電荷。此時再經由高能平行電場加速,再進入質譜儀進行分析。這樣的方式能夠分析帶電量低的分子,以及含有許多不同種類分子的混合物。通常MALDI都會配上精確度高的TOF作為其質量分析單元。
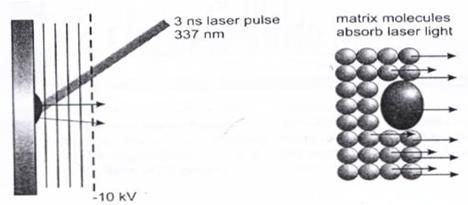
圖4:以MALDI離子化的過程示意圖。
目前常見的MALDI-TOF-MS所使用的雷射光波長為337nm,然而詳細的脫附游離(Desorption / ionization),機制到目前為止並不是那麼清楚,只知道經由這種方式可以使固相或液相的待測物變成氣相,接著在高真空的狀態下 (5x10-6) 加速進行分離。MALDI使用的基質有很多種,最常被使用的基質 (matrix) 有三種 : α-cyano-4-hydroxycinnamic acid (CHCA)、2,5-dihydroxybenzoic acid (DHB) 與sinapinic acid (SA),各基質都有其最適用的分析物,如CHCA通常是用在分析 <10kDa的蛋白質水解片段或是胜肽;DHB可以增強含糖分析物的離子化,因此常作為分析糖蛋白 (glycoprotein) 或是糖胜肽 (glycopeptide) 的基質;而SA則是常用來作為分析大分子量的基質,其他基質及其適用的分析物如表1 所示。圖5為利用CHCA為基質,進行牛血清白蛋白 (Bovine Serum Albumin, BSA) 以trypsin水解之後的胜肽片段產物的質譜分析,可看出每個peptides其質荷比幾乎都在800-2500之間。
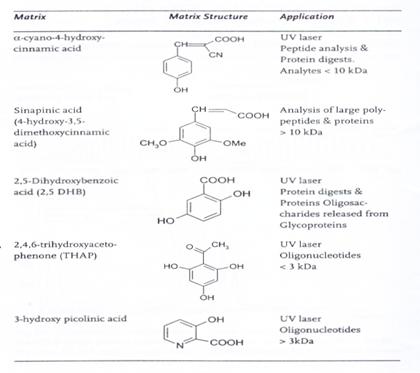
表1:常用的MALDI基質及其適用對象。
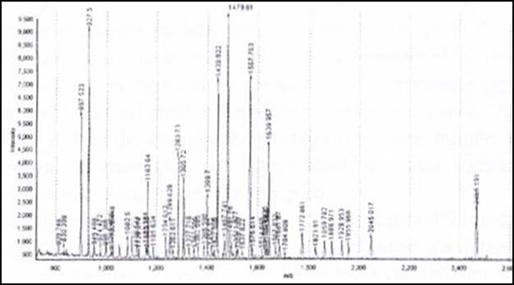
圖5:此為以α-cyano-4-hydroxycinnamic acid為基質所得到的MALDI-TOF 圖譜。
此外,在微生物的辨識上,基質輔助雷射脫附游離法是一個非常有用且極簡便的技術,只要將微生物的懸浮液置於探測棒上,加入適當的基質,待乾後即可置於質譜儀內偵測。許多實驗室已經得到細菌或是病毒特有的生物標籤,這些標籤通常是介於4000-20000 Da之間的蛋白質。一般在製備細菌的懸浮液時,會藉由離心、震盪、或是化學方法使細胞破裂溶解(lysis),以便釋出蛋白質。這些使細胞裂解的方法可適用於一般的生長性細胞(vegetative cell),但是對於有堅硬外殼包覆的孢子(spore)則效果有限。

圖6:樣品以放電處理後的情形
目前已發展出一種新的處理法稱為電暈電漿放電(corona plasma discharge),對於破壞孢子外殼有特別的效果,基本上這一方法是利用一種高頻率、高電壓的產生器,當其電極置於金屬樣品探測頭上方時,會產生一低電流的脈衝,此即電暈電漿放電,如圖5所顯示的,就是樣品受放電處理的情形。置於樣品探測頭上的細菌或是病毒懸浮液乾燥之後,便可施以放電處理,放電時間為30到60秒,之後再加入基質,待乾後再作質譜分析。
放電處理後的生長性細菌的確會釋放較多及較大分子量的生物標籤,圖7是細菌Bacillus subtilis 168未經過及經過放電處理的質譜圖,兩張質譜圖有極大的差異,b圖看到的生物標籤較多,訊號也較強。
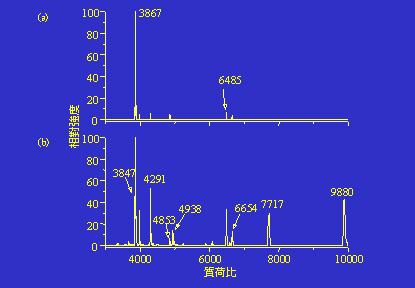
圖7:細菌Bacillus Subtilis 168(a)為經過及(b)經過15秒鐘放電的質譜圖。

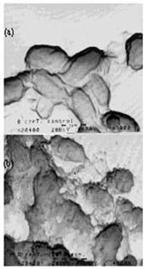 對於不易得到生物標籤的孢子,放電處理的效果也可從圖8的電子顯微鏡照相看出,a與b分別是放電處理前跟處理後的Bacillus
cereus T孢子,雖然孢子不見得完全被打破,但是可看到其表面已明顯被破壞。
對於不易得到生物標籤的孢子,放電處理的效果也可從圖8的電子顯微鏡照相看出,a與b分別是放電處理前跟處理後的Bacillus
cereus T孢子,雖然孢子不見得完全被打破,但是可看到其表面已明顯被破壞。
圖9是五種Bacillus孢子經過放電處理的質譜圖,每一種孢子都可清楚的看到特有的生物標籤。在沒有做放電處理之前,圖中大部份的訊號是偵測不到的。

圖9:五種Bacillus孢子經過放電處理後的質譜圖。
(2)ESI:Electrospray ionization(電灑法;電噴霧離子化)
芬恩於一九一七年在美國紐約市出生,一九四○年畢業於耶魯大學,一九九四年任維吉尼亞聯邦大學教授(2)。於一九八四年首度發表了以電灑的方式作為離子化的方法,目的在於提供一個能和液相層析結合的質譜介面;但一直到一九八八年首度發表了使用此技術分析蛋白質的數據後,電灑法才廣泛的受到世人的注意。
電灑法主要是利用將所欲分析的樣本溶液,由一個前端施以高電壓的毛細管噴灑而出,由於流經毛細管出口時受到電場作用,噴出的液滴會攜帶電荷。帶電荷液滴最終形成帶有電荷的氣相離子,便可送至質譜儀的質量分析系統加以偵測。
帶電荷液滴形成氣相離子過程的理論,目前有兩種說法:一為竇爾(M. Dole)於一九六八年提出的電荷殘留理論,另一為禕瑞苯(J.V. Iribrane)與湯姆森(B.A. Thamson)於一九七六年提出的離子揮發理論。這兩種理論都是結合溶劑揮發和庫倫斥力兩種現象的結果,但多數的研究者認為電荷殘留理論的解釋較合理,因為當溶劑揮發後,電荷仍會留在液滴上,因此最後可形成帶多價電荷的離子。芬恩把離子揮發理論加以改良,用來解釋大分子會帶多價電荷的現象,其原因在於一開始液滴中帶有多個電荷,而且這些電荷也同時被帶有異性電荷的離子包圍;由於大分子在液滴中的布朗運動而移到液滴表面,此時大分子便會取代數個液滴的表面電荷,再藉由熱能的驅動使大分子的一部分帶電區域自液滴表面突出,一旦突破能障後,大分子便與液滴脫離而形成帶多價電荷的離子。(圖10)

圖10:帶電液滴形成氣相離子過程的兩種理論-上:電荷殘留理論(1968, M. Dole);下:離子揮發理論 (1976,J.V.Iribrane &B.A. Thamson)
大氣壓電噴霧 (ESI) 質譜系統,其電噴霧的過程如下:(1) 噴霧器頂端施加一個電場給微滴提供淨電荷;(2) 在高電場下,液滴表面產生高的電應力,使表面被破壞產生微滴;(3) 荷電微滴中溶劑的蒸發;(4) 微滴表面的離子“蒸發”到氣相中,進入質譜儀。(圖11)
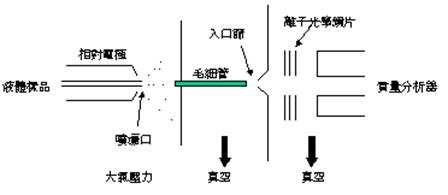
圖11:電噴灑游離質譜儀簡圖

圖12:典型的電噴灑游離質譜圖。
對於大部份生物分子的電噴灑游離質譜分析,電荷的產生主要是氫離子附著在樣品分子的鹼性基團上,因此每一分子所帶氫離子數(電荷數)會是一個分佈,所以質譜圖上會有一系列質量電荷比的訊號。因為這些訊號只差在電荷數的不同,也就是說,訊號的質量電荷比增加時電荷數減少,目前已發展出數種數學方法可以求出其分子量。典型的電噴灑游離質譜圖可以圖12表示,假設樣品分子的質量為M,而其電荷攜帶者 (如H+) 的質量為X,電荷的數目為n,訊號的質量電荷比為m1、m2等,注意訊號m1的值小於m2的值,且m1的電荷 (n1) 大於m2的電荷 (n2) ,如果n1,n2只差一個電荷數 (n1=n2+1),那麼m1,m2可表示如下:
m1 = (M + (n2 + 1)X )/ (n2 + 1) (1)
m2 = (M + n2X) / n2
(2)
由方程式(2)解得M:
M = n2(m2 – X) (3)
將(3)代入(1),求得n2:
n2 = (m1 –
X)/(m2-m1)
將n2、m1、m2及X代入(1)式或(2)式可求得分子量M。我們可選擇質譜圖內其他任何一對相鄰的訊號並重複以上的步驟計算出數個M值,而求得平均M值。
電灑游離法最主要目的是提供一個能和液相層析結合的一種介面,這方法在蛋白質分析及液相層析/質譜領域皆非常重要。由於許多高極性的分子,尤其是蛋白質分子,在加熱時會造成性質的改變而無法被偵測,利用電灑游離質譜法則可以克服這個問題。ESI可以產生多電荷離子,每一個都有準確的小m/z值。正因分子可能攜帶許多不同的電荷,因接上了許多不同數目的質子,故會得到一系列的離子訊號,因而產生了較多的圖譜峰資訊,使得鑑定的工作變得較容易。
如在分析蛋白質時,可利用高電壓(約3000伏特)將溶於水中的蛋白質經由噴嘴噴出許多帶正電(+2~ +40)的小水珠,當水分慢慢蒸發之後,電荷數會慢慢增高,同時蛋白質的濃度也相形增高,此時荷質比高到可以被任何質譜分析儀所分析。同時因為一種分子可以被噴出不同荷質比的氣體分子,因此經由適當的運算(Fenn在1987年提出multiple charge theory),精準的算出被分析分子的分子量。而帶來的另一個好處就是相同的分子可能攜帶不同的電荷,因此會得到一連串的訊號,雖然會使得圖譜變得複雜,但這也產生了更多的資訊,使得鑑定的工作變得較容易 (圖13)。
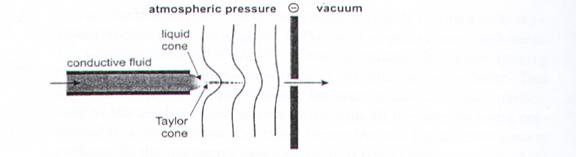
圖13:ESI的圖解
實例說明:圖14說明了用此法分析兩種150Kda的蛋白質,會產生許多同電荷,圖的上面是實際的蛋白質質量,下面是經由ESI所得到的圖,注意charge的數目,原本質量分不太清楚的兩個spectrum(150000),經由ESI質譜分析spectrum數目不同了,也就分得出兩個不同的蛋白質,解析度因此大大的提高,也使得蛋白質的鑑定變的較容易。
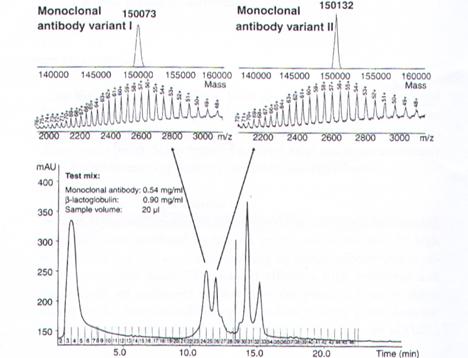
圖14:實際蛋白質質量和ESI分析出的不同結果。
如果是比較小的分子如peptide,如果質譜的解析度夠的話,也很容易的可以知道它的荷質比,進而得知是甚麼樣的peptide。如圖15為tryptic peptide,經由ESI會產生二個或三個離子;如果只有一個spectrum,其12C與13C荷質比(M/Z)為1Da;如果是兩個spectrum的話就是0.5Da(M/2);同理三個的話就是0.33Da…;所以如果已經累積很多經驗在荷質比上,那peptide的質量就可以很容易且精確的知道了。
ESI在微生物的分析應用上,其樣品通常會經過分離處理之後再注入質譜儀,而分離的方法主要是利用高效液相層析法(high performance liquid chromatography,HPLC),至於樣品的處理,一般是將冷凍乾燥後的微生物樣品溶入適當溶劑中(如含3%三氟醋酸的水溶液),搖動數分鐘後離心,取出液體部分,過濾之後再注入液相層析儀分離。分離後各個成分的的質量可由質譜圖中的電荷分佈求得。由此可分辨出不同微生物特有的生物標籤。

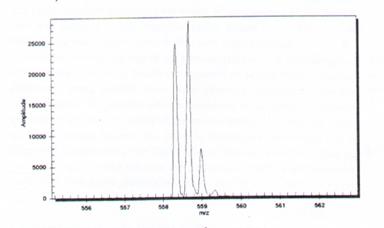
圖15:以trypsin處理後的peptide經ESI可產生帶2個或3個電荷的離子。
在這樣的實驗中,細菌樣品內的鹽類及清潔劑等常常會大量存在,使樣品分析變成一大挑戰,而若要進行樣品的處理,也不能與質譜儀直接連線,需使用ESI-MS才可以克服這個限制。如 Bacillus anthracis、Brucella melitensis、 Francicella tularensis 和Yersinia pestis等致命細菌,已可以利用LC-ESI-MS來加以分辨。更進一步,其它和Bacillus anthracis同屬的非致命細菌也可被區分出。這些同屬的細菌有相當程度的相似性,但還是可以從質譜圖中分辨出它們的不同之處。
ESI-MS除了可以和LC連線外,也可以和其他樣品處理方法連接。一種近來才跟ESI-MS連線的方法是藉由雙重微透析(dual microdialysis)裝置,此裝置可去除微生物萃取液中的干擾物以便質譜儀的分析。

圖16:雙重微透析裝置圖。
如圖16所示,第一道的透析是經由一蛇形的的管路,此管路是由兩片互為鏡像的管路薄片夾著一透析膜(d)所組成,樣品由薄片的一端a進入,部份的樣品透過透析膜而由出口c進入第二階段的透析管,剩餘樣品則經由b流出,此一通路(a-b)可沖洗透析膜避免透析膜遭到阻塞。若是薄膜的使用時間不是考量的因素,出口b也可以封住。藉由調整連接出口b管線的內徑粗細,進入第二階段透析的的流速也可由出口b來調節。第二階段透析是利用透析管(e)包覆在內徑較大的鐵氟龍管內,在兩管之間則通入流動的緩衝溶液幫助透析的進行。第一階段的透析膜可為阻斷30000分子量的纖維素濾膜,此濾膜可阻斷大於50000分子量的分子進入第二道透析,而第二道的透析膜為阻斷5000分子量的纖維素濾膜,如此可使鹽類等小分子被在外部流動的緩衝溶液帶離,經過雙重透析處理的樣品包含大約是1000到20000分子量的分析物經由ESI介面進入質譜儀。
電灑法為現今游離方式中最溫和的一種,且可保持蛋白分子離子化過程中結構的完整性,並可利用多重價電荷的方式偵測巨大生化分子,而擴大了一般質譜儀所能偵測的範圍,這是其他游離法無法做到的。此外,如前面所提電灑法也提供了一個方便和其他液相層析方式(如高效能液相層析儀(HPLC)、毛細管電泳儀(CE))結合的介面,使生化分子的研究更為方便容易。
電噴灑游離質譜術是除了基質輔助雷射脫附游離質譜術之外另一種分析生物分子的方法。由於可使用低的樣品流速及與分離技術結合,其靈敏度大大增加,已成為分析蛋白質的重要工具。但是只有極少的研究是利用電噴灑游離質譜術來分析,這是因為樣品處理較為麻煩,而且質譜圖也較為複雜之故。然而,它也有數個優點。它不但有高靈敏度及可與樣品處理連線,由於大的生物分子可帶多個電荷,使得這些生物分子較易被打碎,如果需要,可對特有的碎片模式做進一步的結構分析。
利用荷質比(m/z:Mass to charge reation)不同分離各個離子的主要場所。
主要可分為下列幾種型式:
(1.) 傳統Mass analyzer
(2.)Time of flight (TOF)
(3.) Quadrupole analyzer
(4.)Quadrupole ion trap
(5.)Fourier transform ion cyclotron (FT-ICR)
(1.) 傳統Mass analyzer (僅適用於小分子)
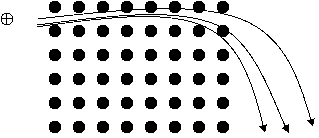
基本原理:利用帶電物質在電場中移動的距離和分子量的大小成正比來區分出物質(圖17)。

![]()

![]()
![]()
![]()
![]()
圖17.表示帶電物質再電場中移動的距離和分子量的大小成正比。

m / z = B2r2e / 2V
m / z = k * r2
※在本公式中,Z值通常表示1,所以m值和 r2成正比關係。
(2.)Time-of-flight Analyzers (TOF)
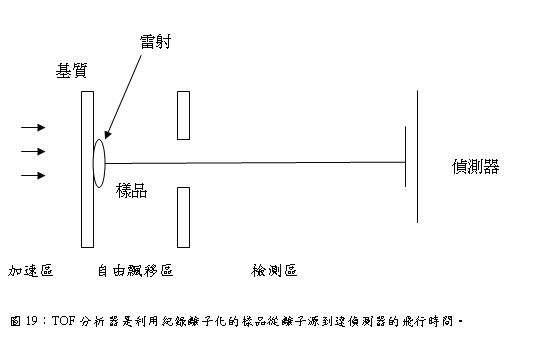
Time-of-flight (TOF)Spectrometer是用來分析由脈衝式釹釔鋁石榴石(Nd-YAG)電射照射樣品產生二次離子,利用離子加速後進入飛行管 (time-of-flight tube)中到達detector所需飛行時間的差異來分離不同質量的離子,質量輕的粒子飛行時間較快,質量重的粒子飛行時間較慢,即比較輕的離子到達detector的時間較快,而較重的離子到達時間較晚(圖18、19)。當離子化所形成之光子飛行路徑越長,雷射質譜儀之解析能力及精度也就越高。亦即如果加長其飛行管 (time-of-flight tube) ,自然可以得到較佳之量測結果。在理想狀態下,Time-of-flight analyzer可偵測到所有的離子,且具有高度的質量解析度。
Time-of-flight Spectrometer具有高離子傳輸率、高質量數分析能力以及可進行高質量解析度分析,此型之分析儀多用於表面成份的分析,尤其是有機物或高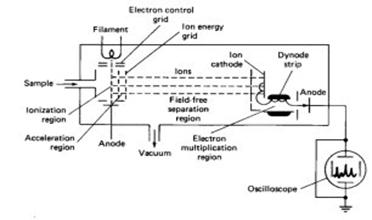
分子的物種分析,但對應用在縱深分析上較差。
圖18:Time-of-flight (TOF)Spectrometer利用樣品分子在離子源(ion source)內游離後,被施以某一特定電壓加速進入飛行管中,再依據質荷比之不同來分離各個樣品離子,較輕的離子比較重的離子先到達偵測器,於是離子到達偵測器的時間便被偵測記錄下來。
因為TOF具備內在的高效能循環(high duty cycle),紀錄的是飄移的時間,因此適用於質量動態範圍大的樣品分析,其檢測公式:
Time of flight(TOF)= k√(M/Z)
所以飛行的時間與荷質比有關,質量越大電荷越小所花的時間越長; 然而其準確性與檢測區的長度和離子化的情況有關。
基本上檢測區越長解析度越好。增加檢測區的長度的確可以增加解析度,但是相對的其他的一些參數問題也會增加,因此現今有兩種方法可以增加TOF的解析度:
A. Incorporation of a reflectron into the flight tube:
在檢測區內加上一個reflectron,reflectron就好像一面鏡子一樣會讓通過檢測區的離子反彈回去,因此增加了檢測區的長度,也增加了飛行的時間(如圖20、21)
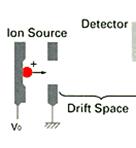
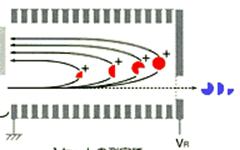
圖20:Reflectron TOF可將檢測區的離子反彈回去,增加了飛行時間,以提高TOF的解析度(28)
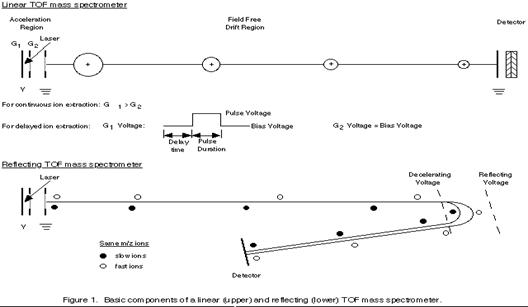
圖21:Liner與reflectron TOF的比較,reflectron增加了檢測區的距離。(27)
B. Time delay ion extraction:
在一開始離子化時,延遲將離子從表面取出的時間,而離子會散佈在自由飄移區,而這時還沒有外加的電場,而移動較快的離子會先比移動較慢的離子飄移出樣本的表面。如果一加入電場,飄移較遠的離子會比較近的離子所帶的potential較低,而在進行飛行時,本來飄移較慢的離子所帶的potential會較高,因此會趕上原本速度較快的離子,所以離子都會聚集在一個固定位置,而在同一個位子離子越密集,其解析度就愈高,因為不會因為分離出樣本的先後造成誤差,也就是大家在同一起跑點。(圖22)
圖22:Reflectron和Timed delay ion extraction TOF在解析度及樣品準確性上的影響。
Quadrupole mass Spectrometer可過濾具有適當的mass-to-charge ratio的原子或分子,即以mass-to-charge ratio來分離離子。Quadrupole mass Spectrometer具有輕巧及操作簡易的特點,由於沒有磁場的磁滯效應,因此可以進行快速的離子掃描監測,利於縱深分析時不同質量數間的轉換,然而其缺點則是離子傳輸率低與質量解析度低。
 四極柱式質譜儀(Quadrupole
Mass Spectrometer)的裝置示意如圖23所示,其主要由四支圓柱形的電極棒(依不同廠商之產品,圓柱形電極棒的直徑有所不同,一般皆在6至I8毫米之間,理論上電極棒越長,質譜儀之解析度越高,但因受RF電壓功率限制,一般長度在125至230毫米之間。)所組成,以四方形之對角線形成雙曲線之排列,電極棒的中央形成一個靜電場(圖24)。
四極柱式質譜儀(Quadrupole
Mass Spectrometer)的裝置示意如圖23所示,其主要由四支圓柱形的電極棒(依不同廠商之產品,圓柱形電極棒的直徑有所不同,一般皆在6至I8毫米之間,理論上電極棒越長,質譜儀之解析度越高,但因受RF電壓功率限制,一般長度在125至230毫米之間。)所組成,以四方形之對角線形成雙曲線之排列,電極棒的中央形成一個靜電場(圖24)。
圖23:四根平行雙曲線桿組成Quadrupole analyser,當氣相離子經過此處時可穩定通過。
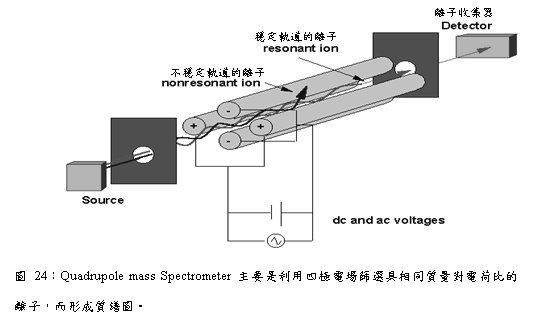
其中相對的電極棒以電線連接,將直流電壓(dc)與射頻電壓(radio frequency, rf)通入其上。Y軸方向的一對電極所加入之直流電壓為負電;X軸方向的一對電極所加入之直流電壓為正電,且射頻電壓與Y軸的相位相差180度。這些直流電壓為正電,和射頻電壓所形成的電場使得離子在其中產生一定規則之振動軌跡,在某一固定的施加電位下,只有某一個質荷比(m/e)的離子呈穩定振動並通過四極圓柱而到達SEM並被偵測到,其他質荷比之離子則因軌道振幅越來越大而撞擊到四極柱上而被中和(圖25)。
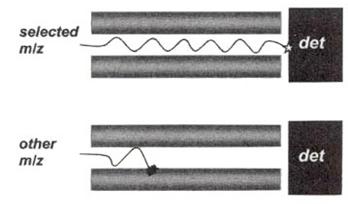
圖25:金屬柱的電流和電壓方向,使離子以螺旋狀軌道行進,唯有具備特定的質荷比之離子能穿越(上);大於或小於此質荷比之離子則無法順利穿越(下)。
不同質量之離子在電場中的解析能力(Mass Resolution),決定於施加在電極柱上dc與rf電壓的比值,固定保持dc與rf電壓的比值,並同時改變dc與rf的電壓,則可改變穿過的m/e值的大小,而使不同質量的離子被偵測到,故四極柱式質譜儀亦可稱為質量過濾器(Mass Filter)。因快速改變dc和rf的電壓,使得四極柱式質譜儀能在微秒的間距中很快地做質量掃描。這種特性非常適合用以偵測TDS進行溫度變化時熱脫附定性及半定量的真實時間掃描。
在圖24中由四極柱質譜儀濾出之離子最後進入偵測系統。本偵測系統由17個分開的電極所構成,電極材料為Cu-Be所組成。當一個正離子打在第一個電極時會激發出2~3個二次電子,而每個被激發的電子又會撞擊下一個電極而放出2~3個二次電子,所以一個離子經SEM (Secondary Electron Multiplier)後可放出217~317個電子,第一個電極可單獨偵測到入射離子的強度而得到放大因子(Amplification Factor)。最後將這些收集到的電訊號經資料處理介面轉換成電腦可辨視的數據,而完成整個量測的過程。
Quadrupole ion trap的作用機制與quadrupole analyser相同,但quadrupole ion trap會形成一個三度空間的陷阱。它本身內部充滿氦氣,由一個環狀電極(ring electrode)以及兩個末端套電極(end cap electrode)所組成(圖26)。

圖26:Quadrupole ion trap的構造。
利用在環狀電極上加上高震盪電壓(RF)而形成三度空間的電場。落入陷阱內的離子會以軌道繞行方式在陷阱內環繞,這個力量是由高震盪電壓以及與氦氣碰撞造成的冷卻效應(cooling effect,氦氣會使離子的動能減少,幫助離子能夠聚焦在陷阱的中心)所造成。如果我們將rf電壓做scanning的動作,離子的軌道就會變得不穩定,就會由低m/z的離子開始脫離陷阱 (圖27)。
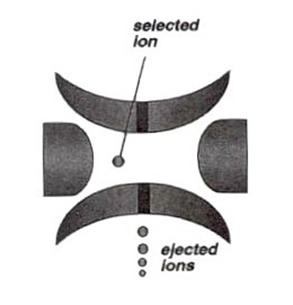
圖27:利用rf電壓去scan,離子的軌道就會變得不穩定,較低質荷比(m/z)的離子會較早開始脫離陷阱。
為了呈現所有在trap中離子的質譜,它會不斷進行「讓trap充滿離子」、「依m/z值掃瞄出離子」的循環,和前面提過的triple quadrupole不同,triple quadurpole是作出連續性的分析,ion trap則是作有規律性的間歇式分析。當目標離子進入,trap的電壓會加高,使離子受到衝擊產生fragmentation(圖28)。

圖28:Trap內的電壓增加會使離子產生fragmentation。
產生的fragments被trap「捕捉」,依m/z值分析(圖29)。

圖29:Fragmentation後的裂片,再依其質荷比做進一步的分析。
Ion-trap的解析力很高,如果將掃描的速度調慢,它能分辨0.05 unit的m/z值差異,在自動化操作的過程中,若再搭配限制質量,甚至能在MS-MS分析前就得知離子的價數狀況(charge state),這對peptide的定序相當有利。
我們可以利用共振激發(resonance excitation)的方式得到一個product ion MS/MS spectrum。Precursor ion可以利用在end cap electrode上加上波型訊號(waveform signal)來分離。Precursor ion的分裂(fragmentation)會經由在end cap electrode之間加上一個小電壓,以及與氦氣碰撞而導致。這種分裂與在triple quadrupole mass spectrometer中觀測到的相似,為一種低能量的碰撞,分裂大部分在peptide amide bond上。對於product ion MS/MS,這個裝置的一個缺點是大約有1/3的precursor ion無法被偵測。依據precursor ion質量的不同,某些由b及y-ion而來的fragment ion無法觀察到。
(5.)Fourier transform ion cyclotron (FT-ICR)
與ion trap相似,FT-ICR可以抓住以及儲存離子。ICR處於一個強磁場中,由在一個方盒子中的三對平行板子所組成。在盒子中,已知m/z值的離子有一個固定的cyclotron frequency以及軌道半徑。當加上與cyclotron frequency相同頻率的rf電壓之後,離子會吸收能量,之後加速而使軌道半徑加大。當除去rf電壓之後,離子會持續以一個穩定的半徑運動。不同cyclotron frequency的離子會保持未激發狀態,因此不同質量的離子可以被分開。
FT-ICR在解析度和質量準確度來說都是表現最好的。此外,它與MALDI和ESI相容,高靈敏度以及MS/MS和MSn的能力使得其在蛋白質體分析應用上的重要性日益升高。
偵測器的主要功能偵測經由質量分析器而來的離子,由於樣品離子的數量十分地稀少,因此要能夠即時且靈敏地偵測到樣品離子,偵測器必須具有強大的增幅 (multiplying) 功能。可以運用於質譜分析的離子增幅偵測器有法拉地杯 (Faraday cup)、二次電子增幅器 (Secondary electron multiplier, SEM)、微通道盤 (Micro Channel Plate, MCP) 與達利偵測器 (Daly detector, 又名光電增幅器, Photomultiplier)。目前最常用的離子增幅偵測器為MCP與SEM,以下分別對各種形式之離子增幅偵測器的原理作一簡單之介紹。
Faraday Cup的作用機制為利用一杯狀金屬偵測器 (如圖31所示),當離子撞擊到杯狀結構時,會激發出許多的二次電子,再被杯狀結構吸收與再激發三次電子,經由此一反覆激發-吸附的結果達到增幅的目的,增幅的幅度大約為103。

圖31:Faraday Cup的作用機制
(2) 二次電子增幅器 (Secondary electron multiplier, SEM)
SEM的作用機制為利用傳統的電極進行多次的電子激發反應,最後再進行增幅電子的偵測 (如圖32所示),增幅的幅度可達106以上。

圖32:Faraday Cup的作用機制
(3) 微通道盤 (Micro Channel Plate, MCP)
微通道盤離子增幅器的原理與SEM很相近,由許多的微通道所組成 (如圖33所示),每一個微通道都具有增幅的功能(如圖34所示),最後的訊號為所有的微通道增幅之後的電子訊號之總和,增幅幅度可達108。

圖33:微通道盤的剖面構造圖

圖34:單一微通道的電子增幅機制。
(4) 達利偵測器 (Daly detector, 又名光電增幅器, Photomultiplier)
達利增幅偵測器/光電增幅器的作用機制是利用離子撞擊傳統的電極板之後,所激發的二次電子透過燐光板或是震盪器激發出光子,所激發的光子再經過光電增幅器進行第三次的增幅(如圖35 所示),增幅的幅度最高可達1010,為增幅幅度最大的離子增幅偵測器。

圖35:光電增幅器的機制
將所得的結果以電腦分析轉化,在資料處理系統中,離子偵測訊號被轉換成可讀或圖譜方式呈現。
質譜儀主要可分為單一MASS和分析離子質量的地方分為兩個或多個步驟的質譜儀,單一的MASS通常為MALDI-TOF,也就是以MALDI作為離子源,以TOF作為analyzer的質譜儀(下表):
Mass analyzer: MALDI-TOF
|
Types |
Inlet Sample introduction |
Ionization method |
mass analyzer |
|
Linear MALDI-TOF |
Solid |
MALDI |
Linear TOF |
|
Reflectron MALDI-TOF |
Solid |
MALDI |
Reflectron TOF |
MALDI: matrix assisted laser desorption ionization method
TOF: time of flight mass analyzer
MALDI(matrix-assisted laser desorption inoization)代表來源(source),也就是離子化的部份,TOF是time of flight的縮寫,代表質析(mass analyzer),整個運作方式如圖36。

圖36:MALDI-TOF MS的運作方式。
圖36中,A:將待測物peptides與一些化學物質(圖中的matrix)混合,matrix中的微小分子,會吸收特殊波長的光,成份包括2,5-dihydroxybenzoicacid、3,5-dimethoxy-4-hydroxycinnamic acid(sinapinic acid),以及α-cyano-4-hydroxycinnamic acid。混合物置於小玻片上,讓水份或其它溶劑揮發到空氣中,造成樣品內部晶格(crystal lattice)的形成,再把樣品放到source的部份,source這兒提供雷射光,matrix的化學物質吸收光子而激發電子,釋放的能量轉到樣品中的peptide上,離開matrix表面進入空氣中。這樣的離子化過程,依樣品的性質,產生正離子或負離子,在蛋白質體學的研究中,通常正離子是我們所感興趣的部份,正離子的產生是在脫離matrix的過程中,接受了質子所致。每一個peptide分子會接受單一的質子,因此,大部份的peptide離子都會帶一個正電,比如一個質量1032的peptide接受了一個質子後,變成【M+H】+的狀態,m/z質成為1033。在MALDI形成這樣的離子後,再送入TOF mass analyzer分析。
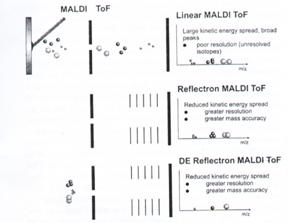
B:TOF (time of flight) 正如其名,能測得離子由analyzer一端到另一端(detector) 的時間,m/z值愈大,時間愈短。MS的優劣是在於能區別離子間微小m/z的差異,但是這種測量直線行進速度的TOF解析力不夠高(以人的眼睛狀況比喻,解析力差的MS就像近視),造成直線型TOF低解析力的原因,在於相同m/z值的離子,直線行進速度也有快慢之別。
C:改良式的TOF,以反射取代直線法。它能使離子經反射而聚焦,擁有相同m/z值的離子便會在同時抵達偵測器。圖37為分析胰島素的例子,說明反射式與直線式的MALDI-TOF得到的結果。
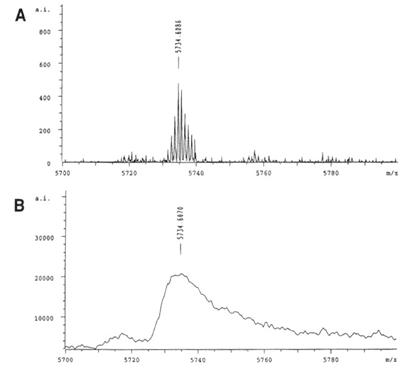
圖37:以胰島素為例說明反射式與直線式的MALDI-TOF
A-反射型的TOF,輕易區分出peptide中的12C和帶有放射性的13C。
B-直線型的TOF,只能測出peptide的平均m/z值。
另一種改善直線型TOF缺點的方法是前面在介紹TOF時已提過的間歇性雷射光(time-delay ion extraction)讓樣品離子化,如此一來會延遲它們進入TOF的時間,使所有離子的起跑點一致,相同m/z值的就會在相同時間到達偵測器了。改良後的MALDI-TOF能區別m/z值只差0.001 amu的樣品。
在分析的時候,調整反射處 (reflectron) 的電壓,使peptide ion的加速度和電離 (ionization) 過程適時緩和下來,穿越TOF的時間不會太快也不會太慢,此時因分子內動能所造成的裂解產物,便可以透過特定的一組反射電壓而分離並且得以偵測到,這種方法便稱之為PSD (post-source decay) MS/MS。雖然PSD MS/MS不是分析peptide 序列最好方法,但是它可以測得特定peptide fragments的質量,尤其是H2N+=CHR的R (胺基酸支鍊side chain) 部份。
(2.) MALDI-TOF在研究peptide序列及鑑定各種蛋白質的應用
使用MALDI-TOF進行蛋白質鑑定中,最常用的便是PMF和PSD MS/MS分析法,PMF的原理已於前面的章節說明過,以下針對PSD進行較詳細之討論:
Post Source Decay (PSD)
這個技術是由Spengler以及其同僚在90年代早期發展,利用MALDI reflectron TOF當作研究peptide序列的方法。他們觀察到MALDI並不是像當初發表時所說的是一種soft ionization (譯按:soft ionization是指對待測物進行離子化而不傷及待測物本身) 技術,因為MALDI產生的離子在進偵測器之前的飛行管 (flight tube) 內就會開始分解。當待測物從來源開始加速時就會進行分解或是來源後分解 (post-source decay),在偵測器前的field free region (自由飄移區) 就會產生product ion。既然離子在加速之後就在field free region中被分解,每個product ion的速度都會跟precursor ion一樣,在線性TOF中它們會在同樣的時間到達偵測器,無法彼此分開。然而,由於product ion的質量比precursor ion小,因此它們的動能也較小。幸好refletron的反射離子能力可以使它當作一個在某些程度上可以適應這些動能差異的一個能量過濾器。所以若想研究的peptide、precursor ion,可以利用ion gate (基本上用電子變流裝置(electrical deflector)) 來選出並進行之後的post-source decay。
然而,傳統的線性reflectron只能適應小範圍的動能差異,也就是說reflectron只能對質量相似的離子聚焦(圖39),在這裡,PSD的離子只有與precursor ion質量大小相似才會正確的被偵測到。因此,想要利用傳統的reflectron做PSD的話,reflectron的電壓必須持續下降,這樣低質量(以及低動能)的離子片段才能聚焦在偵測器上。這個動作叫做reflectron的stepping。在傳統reflectron中,要對全部質量範圍的production做聚焦需要數種不同的電壓或是分成數個部分偵測(可能需要到12個部分)(圖38a)獨立的每個segment會用軟體「連結」起來,產生完整的product ion spectrum。(圖38b)

圖38: Precursor ion以及production經過兩種reflectron的示意圖。上:傳統線性reflectron,下:quadratic field reflectron。
使用quadratic field reflectron做PSD分析可以顯著的減低這些缺點,因為它可以用單一spectrum偵測這些動能大不相同的離子。(圖38、39)這是因為quadratic field reflectron是以非線性的方式逐漸提高,在reflectron內創造出一個完美的二次電場(quadratic field)。結果是,特定precursor ion經由PSD產生的product ion不論其動能為何,全部m/z範圍都會聚焦到偵測器上。因此完整的PSD spectrum就可以在相同實驗條件下花一至二分鐘就可以得到,不需要對每個spectrum做連結的動作。

圖39: 傳統及quadratic field reflectron與時間關係的示意圖。a:用傳統線性reflectron一次只有一小部分的質量範圍被聚焦。b:用傳統線性reflectron要收集完整質量範圍的離子片段需要分成許多部分。c:quadratic field reflectron可以在一個TOF spectrum中聚焦所有質量範圍。
由PSD實驗得到的片段與MS/MS product ion spectrum類似。從peptide主幹分裂下來得到含有N-terminus的b-ion以及含有C-terminus的y-ion含量較多,而a-ion的含量較少。此實驗所得到的資料可以馬上使用在序列分析以及蛋白質鑑定。
Keough以及其同僚發展了一個利用MALDI PSD,在PSD部分促進分裂的方法來分析peptide序列,可以顯著的提高靈敏度。這種方法得到的離子只有y-ion一種,也簡化了轉譯的工作。在原本的方法中,是利用2-sulphonyl acetyl chloride來做peptide digest的動作,它會在每條peptide的N-terminus的a-amino group上(以及lysine側鏈上的e-amino group) label上一個強酸,亞硫酸(sulphonic acid)(pKa<2)。
這個理論假定在MALDI的離子化狀態下,一些tryptic peptide的c-terminal強鹼氨基酸(arginine)會接受質子,而n-terminal的強酸官能基會失去質子(圖40)。額外的質子之後會隨機離子化,接著amide bond就斷裂。為什麼只會有y-ion生成呢?那是因為b-ion上原本存在的正電會與亞硫酸根的負電中和,因此我們無法觀測到。

圖40:n-terminus上強酸根對於c-terminus上Arginine的影響。
對一些末端為arginine的tryptic peptide來說,做label可以大大的促進其分裂,尤其是在MALDI PSD中。圖41描述在PSD實驗中分裂的程度。在這個合成的peptide的例子中,我們可以立即知道16個連續的氨基酸。這個技術可以跟由2D gel而來的protein digest相容。
 圖41:
一條合成peptide藉由CAF而獲得的PSD質譜。於Ettan
MALDI-TOF Pro中進行。(加入250
fmol分析)此peptide的16個氨基酸隨即檢驗出來。雖然序列中含有leucine(L),但是實驗無法檢驗(leucine和isoleucine等重)。dMH+為precursor
ion。注意precursor
ion的強度,在一般的PSD實驗中,離子片段的含量佔了precursor
ion的很小比例。
圖41:
一條合成peptide藉由CAF而獲得的PSD質譜。於Ettan
MALDI-TOF Pro中進行。(加入250
fmol分析)此peptide的16個氨基酸隨即檢驗出來。雖然序列中含有leucine(L),但是實驗無法檢驗(leucine和isoleucine等重)。dMH+為precursor
ion。注意precursor
ion的強度,在一般的PSD實驗中,離子片段的含量佔了precursor
ion的很小比例。
當這個方法同樣也會影響到lysine側鏈上的α-amino group,對於c-terminus為lysine的peptide就顯得不適用。為了讓c-terminus為lysine的peptide也能使用此法,lysine必須要先修飾成類似arginine的衍生物。最近已經有幾個團隊報導了在peptide mass fingerprinting中增進lysine peptide偵測的方法。如果這些方法在labeling之前使用,那麼這個labeling方法對於c-terminus為lysine的peptide也同樣適用。
到了2001年時,加上亞硫酸根的這個方法已經被改進成利用一種在水中穩定的sulphonic NHS ester(圖42),而之後用這種方法得到的PSD質譜就稱為化學輔助分裂(chemically assisted fragmentation, CAF)。

圖42:Sulphonic NHS ester與peptide反應的示意圖。
原本的方法有一個缺點,因為acetyl chloride reagent有吸濕的本性,所以在做實驗的時候環境必須無水。而這個新的水溶性藥劑(acetyl chloride reagent)使得待測物可以少到pmol以下,而且也相容於lysine的修飾作業。這個方式可以讓peptide mass fingerprinting以及之後的序列資訊在一台機器內完成,而且具有良好的靈敏度。這個方法可以用在任何使用MALDI做為離子化裝置的MS/MS機器上,可使帶單一電荷的片段簡單的轉換成peptide序列。
MALDI-TOF-MS 一開始被應用於分析aliquots的sample,用來檢測peptide的純度或用於PMF。這類的應用是由於只有小於0.5μL的sample-matrix 混合物才能其沉澱於target disc。這類的sample製備需考慮這個技術的敏感度和peptide的濃度使其足夠用於分析。幾個實驗室也把實驗重點放於peptide和matrix共同結晶化 (Co-crystallization) 的品質,以創造最理想的情況來增加測量的敏感度和準確性。然而,這類製備物無法承受連續的雷射照射和漂白。因此這種方法不適於recording PSD spectra。
幾個實驗室使用小的吸附性columns來濃縮較大體積的peptide matrix以利分析。加入少量的RP-chromatographic beads 到peptides混合物中,這些beads被wash後再轉移到target disc上並風乾,這種peptide-bead濃縮程序可濃縮peptides並形成為小的結晶體,因此可創造出PSD分析法最理想的情況。
更進一步是藉由sample surface的還原來增加敏感度。最理想的sample surface 不應大於雷射光束的直徑。當一小滴放在這個surface上,peptides會脫水而濃縮成較小的體積。現今,相似的設計也可運用至oligonucleotides上。在一厭水的環境下,創造一個小的親水位置,可以避免peptide-matrix溶液在targrt surface隨機的結晶。在理想情況下,sample會結晶成非常小的spot,因此大大的增加測量的敏感度。
另一類分析離子質量的地方分為兩個或多個步驟的質譜儀:
Tandem Mass analyzer: M1-collision cell-M2
|
Types |
Inlet Sample introduction |
Ionization method |
M1-collision cell-M2 |
|
ESI -triple quadrupole |
Liquid |
ESI |
Q1-q2-Q3 |
|
MALDI-TOF-TOF |
Solid |
MALDI |
TOF-CID-TOF |
|
MALDI-Q-TOF |
Solid |
MALDI |
Q- CID-TOF |
|
ESI-Q-TOF |
Liquid |
ESI |
Q- CID-TOF |
ESI: electrospray ionization method; MALDI: matrix assisted laser desorption ionization method
M1, M2: first, second mass analyzer;
Q: quadrupole mass analyzer; Q1, q2, Q3: first, second, and third quadrupole analyzer
TOF: time of flight mass analyzer;
CID: collision-induced dissociation
Tandem mass spectrometry (MS/MS)
已知mass spectrometry主要有兩種運作方式。一種是MS模式可以測量分子量,之後推斷其組成物,另一種是測量某些特定離子的質量,也就是將其在mass spectrometer中選取以及分解,得到結構上的資訊。分裂是在mass spectrometer中利用collision induced dissociation(CID)進行。
這個技術是在可以選擇特定m/z值離子的儀器中進行,之後在mass spectrometer中將選取的離子做fragmentation (裂解)的動作。基本上,這些實驗可在兩種儀器上進行,其一是排成一列的analyzer (串連的空間),像是triple quadrupole以及hybrid quadrupole-TOF,其二是利用捕捉離子的機制,像是quadrupole ion trap及FT-ICR analyzer (串連的時間)。
在蛋白質體學中,常常利用三種MS/MS實驗來解決問題。圖43表示了此三種實驗的示意,我們可以將其中的analyzer分成三部分來看:MS1,collision cell,以及MS2。

圖43:三種MS/MS實驗示意圖。上:product ion scan,中:parent ion scan,下:neutral loss scan。
在product ion scan中,MS1用來選擇我們想要的特定離子,也就是precursor ion (例如peptide)。Precursor ion之後進入collision cell中,在那裡會進行CID (圖43)。在這裡,peptide precursor ion會與碰撞氣體(collision gas,氬氣或氮氣) 分子產生碰撞,造成precursor ion分裂,成為product ion。產生出的product ion會被MS2解析,之後會送到偵測器,做出product ion的質譜出來。以hybrid quardrupole TOF analyser為例,MS2是一個reflectron TOF analyzer。在TOF/TOF系統中,第一個TOF當作MS1,第二個TOF當作MS2。圖44描述了實驗流程,首先我們要的離子在MS1被選擇出來,之後被分裂,得到product ion MS/MS spectrum。

圖44:Product ion MS/MS實驗流程。
CID可以定義成在collision cell中觀測到的碰撞能量。在triple quadrupole,quadrupole ion trap以及hybrid quadrupole TOF analyser中的fragmentation發生在碰撞能量為10-100 eV的範圍中,而在magnetic sector或TOF/TOF analyser中的fragmentation發生在碰撞能量在keV的範圍。前者被稱為低能量CID,而後者稱為高能量CID。
低能量碰撞的結果,我們可以預測peptide precursor ion斷裂在每個amide bond上,這會使production形成一系列的長短不同的離子。這種斷裂方式是在1984年由Roepstorff及Fohlman提出。見圖45。

圖45:Roepstorff及Fohlman提出的斷裂法。只包括低能量CID。(a-, b-, y-type ions)
peptide會被分裂成兩種互補的離子系列:
u N-terminal離子系列(N-terminal ion series),或稱b-ion series。N-terminal ion series的離子會含有N-terminal amino acid,以及由這個residue延伸的其他amino acid。(圖 46)
u C-terminal離子系列(C-terminal ion series),或稱y-ion series。C-terminal ion series的離子會含有C-terminal amino acid,以及由這個residue延伸的其他amino acid。(圖 46)
Precursor ion以及之後的production會進行額外的分裂,去掉以下的小分子:
u 氨(ammonia)(由鹼性residue而來,像是arginine及lysine)
u 水(從含有OH-residue 如serine和threonine而來,以及COOH-residue而來,如glutamic acid及aspartic acid。)
u
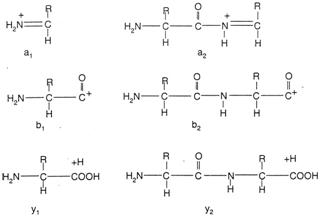
一氧化碳,由b-ion上掉下,b-ion變成a-ion (另一種n-terminal ion)。
圖46:由低能量CID所分裂出的離子結構。
|
離子片段 |
方程式 |
|
a-ion |
離子中所有amino acid residue的質量-28(CO的缺失) |
|
b-ion |
離子中所有amino acid residue的質量 |
|
y-ion |
離子中所有amino acid residue的質量+18+1 |
表2 在低能量CID中產生的常見離子片段,以及每個離子計算質量的算式。
在高碰撞能量下,peptide會進一步在side chain上被分裂。雖然這種方式會得到額外的資訊,像是區分leucine和isolucine的不同,但是它做出來的質譜更為複雜,基本上在研究peptide的序列這方面不會比低能量CID更有用。
我們可以利用Product ion MS/MS spectrum來得知peptide的序列,之後與蛋白質資料庫做比對而鑑定此蛋白質。
在這樣實驗中,MS1可設定成讓所有物質都進入collision cell中進行碰撞誘導性裂解 (Collision Induced Decay, CID)。而MS2固定在某個特定的質量,如此只有那個質量的離子會被偵測器偵測到。利用這種方式precursor ion scan可以被用於在一堆混合物中選擇性的鑑定某種物質,包括phosphorylation site。
例如,在一堆複雜的peptide中有被磷酸化在serine,threonine或tyrosine 等residues的peptides,可以利用這種MS/MS實驗作分析。經過低能量碰撞分裂得到的磷酸化的peptide片段可以得到一個79 Da的片段 (PO3-官能基)。因此要鑑定這些磷酸化的peptide就可將MS2設成79。這樣一來就有會分裂出79 Da的離子的peptide會被偵測到。
這樣的實驗以前只能利用triple quadrupole來進行,但最近有人使用hybrid quadrupole TOF儀器來進行 ,這個方法被用在許多蛋白質混合物中偵測tyrosine磷酸化的peptide。
在這個實驗中,MS1和MS2會同時做一個scanning的動作,但是彼此會有一個m/z值的offset。而這裡的collision cell跟前面所述的precursor ion scan一樣,會允許所有物質進入,但只有產生跟offset值一樣大小片段的物質會被偵測器偵測到。舉例來說,一個具有被磷酸化的serine和threonine 的peptide在進行低能量CID時會失去磷酸 (phosphoric acid)。磷酸的分子量為98 Da,因此對一條二價的peptide,offset應該調成49。因此任何會失去49 Da的二價peptide都會被偵測器發現,代表磷酸化的存在。
MSn (除上述外的另一種MS/MS實驗方式)
這種實驗只能利用quadrupole ion trap和FT-ICR MS。在product ion MS/MS spectrum中產生的離子片段可以再被選取、分離以及分裂,以便提供更進一步的資訊。這種質譜可以叫做MS/MS/MS product ion spectrum或是MS3(圖47)。如果實驗材料充足,這種實驗可以分析phosphorylation或是glycosylation。
圖47:MS3實驗流程示意圖
ESI-tandem MS (electrospray ionization-tandem mass spectrometry)又稱為ESI-MS-MS,ESI是離子產生的過程,tandem mass spectrometry是分析離子質量的地方,分為兩個或更多個步驟。ESI source的構造較簡單,樣品通常由HPLC純化出來後,流入ion source的地方,經過高電壓的不繡鋼管或針頭,以滴狀物的形式噴出,每一滴都含有胜肽離子(peptide ions) 和HPLC的移動相物質,如水、acetonitrile 、acetic acid等。接著,source以加熱或給予氮氣的方式,分開peptide ions與其它物質,將peptide ions送入analyzer分析,其他物質以抽真空的方式排出。整個流程如圖48所示。

圖48:ESI tandem MS的流程圖。
ESI的樣品和MALDI 中晶格化的樣品有所不同,ESI的樣品是放在溶液中的,溶液pH值的高低,控制了樣品的官能基 (functional group) 離子化的狀況,pH值約高於5,C-terminal的部份才會離子化,pH值低於7的時候,N-terminal及胺基酸histidine的氮才會游離,lysine和arginine的N端通常要低於pH8.5才會離子化,這表示在酸性溶液中 (如pH3.5或更低) 會使蛋白質帶正電,在鹼性環境中則讓蛋白質帶負電,所以ESI一般都在酸性環境下分析帶正電的peptide ions。
在分析前,使用胰蛋白酶 (trypsin) 水解蛋白質的結果,因為酵素切點的位置,使作用完的peptides裸露出lysine、arginine部份,加上低pH值的環境,這些peptides變成帶有多個正電的狀態。舉例來說,帶有一個質子的20kDa (m/z = 20,001) 蛋白質,其實在溶液中可以接受10~30個質子,因此這些蛋白質分子有的含有20個質子,m/z值為20,020/20=1001;有的含有21個質子,m/z值是20,021/21=953;有的含19個質子,m/z值是20,019/19=1053。ESI mass spectrum之所以被稱為「多價封套 (multicharge envelope)」,正是因為它能捕捉到不同價數的蛋白質狀態,圖50是以此法分析牛的apomyoglobin結果,再透過軟體,將這些訊息顯示為真正的蛋白質質量(圖50)。
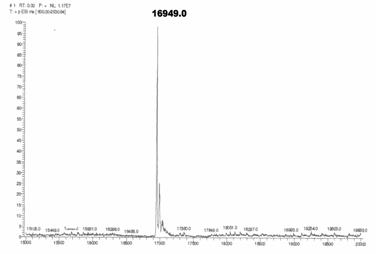

圖49:以ESI tandem MS分析牛的apomyoglobin的質譜圖。
圖50:經過軟體後所顯示的真正蛋白質質量
較小的蛋白質(250~2500 Da)依其大小及鹼性胺基酸多寡,通常以一至三價混合離子的形式存在,拿胰蛋白酶切完產生的peptide「DAFLGSFLYEYSR」為例,ESI-MS分析的結果如圖51,一價的m/z為1567.9,二價的離子m/z為784.7。

圖51:DAFLGSFLYEYSR經trypsin 切完後經MS-MS分析的結果。
(2)ESI-triple quadrupole與ESI-Q-TOP
在蛋白質體學研究中,目前有三種分析儀 (analyzer) 搭配ESI source使用,分別是triple quadrupole (又稱為triple quad)、ion trap和quadrupole-time of flight (Q-TOF)。三種的運作方式雖有差別,共同點是會選擇source送來的peptide ion 其中一種m/z值進行CID,使得peptide ion片段化且變成電中性,分析m/z值後產生離子光譜 (ion spectrum),由tandem 或MS/MS圖譜的資訊,可以推知peptide的序列,由MS/MS spectrum還可以知道序列的何處經過修飾。
由source來的離子會先經過第一個quadrupole (Q1)作快速掃瞄 (rapid scanning),記錄下所有時間通過的所有離子m/z值,這種模式為「full-scan mode」:

圖52:ESI-triple quadrupole的結構示意圖
我們也可以調整Q1電壓,讓它成為一個「質量過濾器」(mass filter),只能讓特定的m/z值離子通過,這些離子進入第二個quadrupole (Q2) 後,經argon原子的碰撞而裂解化 (fragmentation),在第三個quadrupole (Q3) 分析m/z值,這種模式稱為「MS/MS mode」,M/S-MS 分析的效果,和Q1電壓的設定、Q2中Ar 氣壓的大小與CID的能量給予有很大的關聯性。它的流程如圖53。
Q-TOF 和triple quad大致相似,唯一不同的是它的Q3部份是TOF mass analyzer。

圖53:MS/MS mode(有設定特定Q1電壓可讓特定m/z值的離子通過)。
TOF/TOF analyser最近與MALDI ion source裝置在一起(Medzihradszky et al. 2000),用來產生由高能量碰撞導致分離(相對於之前提到的analyser所做的低能量碰撞)而得的peptide的質量指紋(mass fingerprint)以及peptide序列。此系統是由2個TOF analyzer和1個 collision cell,而此兩個TOF analyser是由一個collision cell隔開,第一個ion analyser用來選擇precursor ion,高能碰撞發生在collision cell中,而第二個TOF analyser則負責分離ion。
對蛋白質體分析來說,只有一組quadrupole analyzer的效果幾乎微不足道,但是如果三組quadrupole analyzer依序排列起來所形成的triple quadrupole analyzer對於蛋白質體的分析很有用。這個裝置用來提供結構上的訊息。在這裡第一和第三組quadrupole當作mass filter,第二組則當作一個碰撞室(collision cell)。
將兩種主要的MS介紹完,可看出各種MS的優勢所在但世上並沒有完美的MS機種,但是以MALDI-TOF MS而論則有下列四大優勢:
(1)操作簡便,它的操作介面人性化,使用者較易上手,是所有MS中最容易學會的一種,在資源共享的實驗團隊裡,它可以在一天之內分析上百件樣品。
(2)需要大量製備蛋白質樣品的地方,目前從2D 電泳膠體的製作、蛋白質點(protein spots)的取出及酵素水解,都採用自動化的設備,MALDI-TOP也能以這樣的形式存在,減少人力、提高效率。
(3)隨著TOF分析方式的改良,得到的蛋白質體數據也愈正確。
(4)MALDI-TOF MS的靈敏度高,可以偵測到少量的(可到10-18 mole)蛋白質。
雖然MALDI-TOF MS有這麼多好處,有時我們仍會使用其它種類的MS,這是因為MALDI-TOF MS可以提供正確的「質量(mass)」資訊,卻不能獲得詳細的「序列(sequence data)」。雖然PSD的改良固然使MALDI-TOF MS能看到序列,詳盡與正確度仍不及ESI tandem MS(electrospray ionization-tandem mass spectrometry)。除此之外,分析的成敗,幾乎取決於樣品當初製備的品質如何,如果樣品在水解過程被金屬、鹽類、尿素、丙醇污染,或是界面活性劑(detergent)沒有去除乾淨,都會使樣品在MALDI source的電離(ionization)受到極大的影響。當然,樣品的污染會影響所有的MS分析,不過MALDI-TOF MS對此特別敏感,因為它沒有再經HPLC系統去除雜質的步驟。
ESI-MS和MALDI-TOFMS在分子量測定的靈敏度、準確性和對複雜體系分析能力方面均比以前的技術有了顯著的改善,主要差別在於ESI須配合液體進樣系統,且形成多電荷分子,故圖表中多個Peak可能只代表一個分子;而MALDI以固體進樣系統,而行單電荷分子。兩者皆大大拓寬了質譜技術在糖分析中的應用,但仍存在不少問題需要解決。如,ESI的多電荷離子使譜圖解析複雜化且對樣品要求高,不能有鹽和表面活性劑;MALDI-TOF MS的解析度低,結構資訊有限,基體的選擇仍是憑經驗,對於基體輔助的機理仍不是很清楚,聯用困難。
在了解MS的原理、構造、功能,及各種MS的優勢,可發現MS儘管有靈敏度高(僅須一點sample的量,即可作鑑定)、解析力好(可以分辨至5Da的差異)、獲得詳細訊息(可以知道Internal sequence和characterization)這些優點,但仍有無法定量(因為必須將peptide游離,但每個peptide的游離程度不同,因此無法做蛋白質的定量。)的缺點,尤其在評估一台MS的價值時,更可依下列三點作為判斷:
a. Mass accuracy:準確度。
b. Senstivity:靈敏度,也就是蛋白質的偵測所需的濃度 。
c. Resolution:解析力,也就是能分別蛋白質分子量差異的能力
有鑑於質譜儀與核磁共振儀對於現今研究蛋白之性質與結構確實具有卓越之貢獻,2002年諾貝爾化學獎的榮耀便因而落在為這領域帶來突破性發展的人士—即美國學者約翰.芬恩 (John B. Fenn)、日本研發工程師田中耕一 (Koichi Tanaka),及瑞士籍研究教授伍斯瑞許 (Kurt Wuthrich) —以表彰他們對於將質譜技術應用到研究大分子有機化合物如蛋白質,進而推動蛋白質體學突飛猛進的貢獻。其中在質譜儀的貢獻上是由美國學者約翰.芬恩(John B. Fenn)、日本研發工程師田中耕一 (Koichi Tanaka)共同獲得這項榮譽。
藉由1-D或2-D膠電泳連結可利用的蛋白質序列databases來預測蛋白質的表現或蛋白質間交互作用。現今,許多真核和原核生物的基因組已被定序完成。早期蛋白質的鑑定是建立在Edman degradation的技術上,現今在各種質譜技術如MALDI-TOF-MS、Q-TOF、Triple Quadrupole、FT-ICR與SELDI的進步下,已成為蛋白質鑑定的主要技術。目前MALDI-TOF-MS的整個操作流程已可以完全自動化,因此可避免人為操作污染,此外MALDI-TOF-MS技術具有高靈敏度與高精確度等優點,大幅提升以PMF、PSD-MS/MS或是CID-MS/MS進行蛋白質之鑑定的效率。
由於ESI-MS的靈敏度與精確度低於MALDI-TOF-MS,所以在分析與鑑定蛋白質時較少利用到ESI-MS,但是Tandem MS 的技術在分析不同蛋白質的後轉譯修飾 (post-translational modification, PTM) 上卻扮演著相當重要的角色。也因為ESI-MS 與MALDI-TOF-MS之間的相輔相成、互補有餘,正是使得今日蛋白質體學研究可以日新月異的最大功臣。
參考資料:
1. 王應瓊著,儀器分析上冊,中央圖書出版社,p.165-167
2. 王文竹,透視生物巨分子結構,科學月刊,2002,396:1033~1036
3. 史世華,基質輔助雷射脫附游離—飛行時間質譜技術及其應用,科學新知,88.6:70~80。
4. 吳慧芬、呂麗琪,質譜儀分析技術的突破開展生化科技新領域,科學發展,2003,362:49~51。
5. Daniel C. Liebler Introduction to Proteomics-Tools for the New Bioloogy P55~76 Humana Press Inc. (2002)
6. Gibson BW and Biemann K. 1984. Strategy for the mass spectrometric verification and correction of the primary structures of proteins deduced from their DNA sequences. Proc. Natl. Acad. Sci., 81: 1956-1960.
7. Karas M, and Hillenkamp F. 1988. Laser desorption ionization of proteins with molecular masses exceeding 10,000 Da. Anal. Chem., 60: 2299-2301.
8. Mike Tyers and Matthias Mann. 2003. From genomics to proteomics. Nature, 422: 193-197.
9. http://www.chemedu.ch.ntu.edu.tw/lecture/nobel2002.htm
這是一個介紹2002年化學諾貝爾獎的網頁,他主要是翻譯了諾貝爾化獎委員會公佈給大眾的新聞稿(由 蔡蘊明翻譯),內容是敘述2002年化學諾貝爾獎所帶來的影響。而且網頁上也有直接連結到諾貝爾委員會的網站,可以進一步多了解其他的諾貝爾獎。
10. http://www.yy2000.com/xinyaodongtai/zhipuzaitang.htm
這個網站是在介紹質譜在糖分析中的應用,是一個中文簡體網站,他簡單介紹MS的原理。
11. http://www.nes.coventry.ac.uk/research/cmbe/306che/306che52.htm
這是一個很詳細介紹mass的網站,除了MASS的各個部分的介紹之外,這個網站主要是各式的光譜儀的介紹,其中還包括NMR,尤其介紹原理很清楚而且也有很多的圖片說明。
12. http://mass.chem.nsysu.edu.tw/chinese/instrument/instrument.htm
這是中山大學有機化學質譜實驗室的網站,其中有質譜儀的照片以及簡單的儀器介紹。
13.
http://www.nchu.edu.tw/~rict/hrms/hrms1.GIF
這是中興大學貴重儀器中心的網站,其中有高解析質譜儀(HRMS)的原理、功能說明,並有對外開放使用的服務項目。
14.http://memo.cgu.edu.tw/research/corelab/%E8%9B%8B%E7%99%BD%E8%B3%AA%E9%AB%94%E5%AD%B8%E7%B0%A1%E4%BB%8B.htm
這是長庚大學基研所的余兆松老師所寫有關蛋白質體學的簡單介紹,並提
到蛋白質體學中常使用到的質譜儀及質譜儀在醫學上的應用。
15.
http://www.mc.ntu.edu.tw/staff/ard/Paper/LCMSMS.htm
這是台灣大學的儀器分析的介紹網頁,主要是介紹液相層析儀/質譜儀結合的質譜儀。
16. http://www.ndl.gov.tw/ndlcomm/P6_2/43.htm
這是國家奈米元件實驗室的網頁,在介紹TD-APIMS (Thermal Desorption- Atmospheric Pressure Ionization Mass Spectrometer)—熱脫附的大氣壓力游離法的質譜儀,內由詳細的原理介紹及應用。
17. http://www.abrf.org/ABRFNews/1997/June1997/jun97lennon.html
這是介紹MALDI-TOF MS的網站,由華盛頓大學-John J. Lennon所編寫的,網頁中有詳細的原理解釋,並且有清楚的圖,可以讓人更易於了解。
18. http://www.an.shimadzu.co.jp/bio/product/tech.htm
這是個日本公司-SHIMADZU的網站,網頁中有介紹一些分析儀器,並附有精美的圖解說明儀器的原理,可藉由這些說明更加了解儀器的作用原理。