親和層析法 (Affinity chromatography)
親和層析(affinity chromatography)也稱為功能層析(function chromatography)、生物專一吸附(biospecific adsorption)或是選擇層析(selective chromatography)。所謂的親和力,乃生物大分子和其配體(ligand)之間形成可逆結合的能力,如酵素和它的受質(substrate)、抗體和抗原、激素和受體(receptor)、RNA和其互補的DNA等,親和層析就是根據這種親和力發展出來的純化方法,例如將酶的substrate接在固體支持物上,再用此支持物填裝管柱,當含有這種酶的樣品溶液通過管柱時,酶便被吸附在管柱上,其它的蛋白質及雜質不被吸附,全部從層析柱流出,最後使用適當的緩衝液,將欲分離的酶從柱中洗出來,經過這些步驟便能得到純化的酶。整個過程如下:
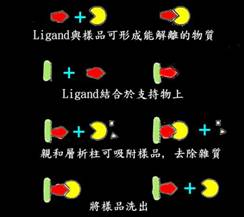
欲進行親和層析,ligand的選擇相當重要,ligand可以是輔酶、酶的抑制劑或抗體,具備的條件如下:
1.
能與欲分離的物質進行專一性的結合,親和力愈大愈好。
2.
Ligand與分子結合後,在一定的條件下又能解離,而且不會因解離破壞原本的生物活性。
3. Ligand上具有能連結到固體支持物上的團基,結合後不影響它與欲分離物質的結合專一性。
在實際操作上,若要純化的是某一種酶,則lignad選用此酶的競爭性抑制劑、受質(substrate)、輔酶或是效應劑(effector );若是要純化酶的抑制劑,就選用此酶作為ligand;純化能與某維生素結合的蛋白質,可以使用這種維生素當ligand;純化激素的受體(receptor),選用荷爾蒙當ligand。純化核酸可利用核酸與蛋白質的交互作用、DNA之間的互補關係、DNA與RNA的hybridization,運用適當的ligand。
親和層析中與ligand連接的支持物多為凝膠,凝膠應具備以下條件:
1.
不溶於水但具有親水性,如此ligand才容易接近水溶液中的欲分離物。
2.
化學惰性,沒有(或極少)離子交換這一類非專一性的結合。
3.
具有足夠的化學團基,經活化後能與大量的ligand結合。
4.
最好是均一的球狀顆粒,製成的管柱才能有較佳的流速。
5.
具有多孔網狀結構,方便大分子自由通過。
6. 物理及化學性質穩定,不因洗出時改變的各種pH 值、離子濃度、溫度或界面活性劑而改變其結構。
親和層析法使用的支持物種類,部份與膠體過濾法重覆,除了Polydextran、Polyacrylamide、Agarose以外,Ultrogel是能承受較大壓力的凝膠,流速高;cellulose 主要用於親和免疫層析,但它有非專一性吸附的性質;Bio-glass是硼矽酸鈉經高溫和酸鹼處理製成的多孔玻璃,質地硬、強度高、孔徑均勻、不怕微生物侵襲,但缺點和cellulose一樣,它的表面對蛋白質也有非專一性吸附。
要使欲分離的物質與ligand分離,通常採用改變pH、離子濃度或緩衝液的組成,使其親和力降低,有時使用0.1M醋酸或0.1M 氫氧化鈉沖洗,就能得到不錯的效果。如果純化對象與ligand的親和力不強,當連續通過大量的平衡緩衝液,就能在雜質洗出後,得到所要的物質;若親和力較強,則要使用較強的酸或鹼作為沖洗液,或是添加guanidine hydrochloride,但這些溶液容易使純化對象失去生物活性;用較高濃度的ligand溶液亦可將管柱上所吸附的物質洗出,此ligand可以與管柱上的相同或相異。
對於親和力小的物質,上柱的樣品最好是體積小而濃度高,黏度較大的溶液,可以將一定量的ligand加到待分離的溶液中,攪拌平衡一段時間,進行過濾或離心,最後進行洗出的步驟。由於生物大分子和其ligand間達到反應平衡的速度很慢,樣品上柱的流速要儘量慢;通常親和力會隨溫度增高而降低,其中一例是將乳酸脫氫酶從管柱上的AMP洗下來時,所需的NADH濃度隨溫度增高而減少,在攝氏零度到十度間的變化尤其明顯,因此如果待分離的物質在攝氏4度可被緊密吸附,在攝氏25度以上容易被洗下來,則可在4度環境下進行親和吸附,在25度以上的環境進行洗出的步驟。
1. 核酸的純化
因為DNA與RNA之間具有專一性的親和力,所以親和層析也應用於核酸的研究,在這當中,單股DNA與纖維素(cellulose)組合的凝膠,已成為分離mRNA的重要方法之一,例如欲從大腸桿菌的RNA混合物中分離出專一於噬菌體T4 的RNA,可將T4的DNA以共價鍵結方式接於cellulose材質的管柱中,再將所要的RNA分離出。
此外,根據核酸與蛋白質之間交互作用的原理,可以將單股DNA接在Sepharose上,純化DNA聚合酶或RNA聚合酶。
2. 激素受體(receptor)的純化
激素受體是細胞膜上與特定激素結合的成份,激素和受體的作用具有特異性,目前用親和層析法已經能藉由激素與sephrose的組合,純化胰島素、正甲狀腺素的受體。
3. 抗體與抗原的純化
抗體與它相對應的抗原結合具有高度專一性,Sepharose是這一類親和層析較佳的載體,由於抗原-抗體複合物的解離常數很低,因此抗原在固定化抗體上被吸附後,要盡快將它洗出,沖洗液的條件通常是控制pH值至3以下,成份為醋酸、鹽酸、甘胺酸-鹽酸緩衝液、20% 甲酸或1M 丙酸,也有使用尿素這一類的蛋白質變性劑作為洗出用的溶液。
4. 酶和酶的抑制劑純化
使用親和層析法純化酶,可以得到相當好的效果,舉例來說,要分離豬和牛的胰蛋白酶,可以連接雞卵黏蛋白(胰蛋白酶的抑制劑)與Sepharose 4B當作層析柱材質,用它純化出來的胰蛋白酶相當於5次再結晶的純度。除了使用抑制劑當ligand,也可以反過來用酶作為ligand來純化抑制劑,例如將胰蛋白酶接到Sepharose上,能有效分離純化大腸桿菌中的胰蛋白抑制劑Ecotin。
※參考資料: 李建武等合編 生物化學實驗原理和方法 P94~110
藝軒圖書出版社 (1999)