蛋白質結構
整理: 黃信明
一、肽鍵的平面性質(Planar nature of the peptide bond)
四、纖維狀與球狀蛋白(Fibrous and globular proteins)
3.蛋白質的三級構造(Tertiary structure of proteins)
一、高度解析X-射線結晶學(High resolution x-ray crystallograply)
二、極性與非極性胺基酸(polar and nonpolar residues)
三、蛋白質的摺合(Folding of the protein molecule)
將蛋白質中胺基酸順序視為整體構造,是一種用有機化學詞語來描述分子的完全方法。自很多不同蛋白質的順序分析中可以看出,每種蛋白質都有其獨特的結構,而順序排列即是該種系的特性。在少數的情形中,特殊的器官或組織也具有特定結構的蛋白質,更進一步的,蛋白質可以如細胞分裂一般很正確地被複製出相同順序的蛋白質。我們可以參考牛的胰島素(Bovine insulin);更正確地說,是參考proinsulin。Proinsulin為生物活性賀爾蒙的先質(precursor),藉著正常牛的胰臟島狀細胞仔,細地做成的一種特定構造。牛的胰島素和其他哺乳類的胰島素幾乎是相同的,通常只有一個胺基酸不同,即A鏈中第8,9或10位置胺基酸的改變。這些相似性使得這方面的研究迅速擴展,雖然在不同種類中,胺基酸會發生變化,但在18位置的胺基酸很明顯地絕不會改變。研究不同種系中蛋白質的順序,是現在研究構造與功能間關係的一種方法。
蛋白質的一級構造提供了我們分子有機-化學的性質描述,但卻不能描述蛋白質中聚肽鏈的構造,必須使用其他實驗方法後才能得到蛋白質分子的真正構造。
一、肽鍵的平面性質(Planar nature of the peptide bond)
四、纖維狀與球狀蛋白(Fibrous and globular proteins)
一、肽鍵的平面性質(Planar nature of the peptide bond)
用物理方法測定不同種類的蛋白質,顯示球狀蛋白質(globular protein)不適合用直線延展的聚肽鏈表示,而要用緊而高度摺疊的結構表示。因此蛋白質分子的完整描述,必須包括聚肽鏈之形態,以及支鏈上取代基的位置、鍵結的詳細分析。蛋白質的二級構造,正是和聚肽鏈的三度空間排列有關的構造。
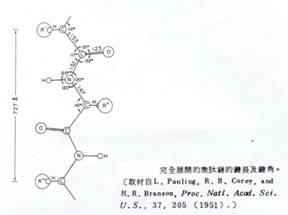
Pauling與Corey用x-光繞射(x-ray diffraction)研究個別的胺基酸,以及許多dipeptide與tripeptide,以此建立peptide的結構單位。α-碳原子的鍵角及鍵長是和標準的正四面體的碳相同,然而在peptide bond中C-N鍵的長度則在單鍵及雙鍵長之間;peptide bond的部分雙鍵性質有助於Pauling及Corey瞭解peptide bond的面性質。在peptide bond上的四個取代基(substituents)幾乎全部都是反式配置(trans-configuration),因此在carbonyl group上的氧與在氮上的氫,位置是成對角線的。
在有兩個或更多的胺基酸參與聚肽鏈結合時,peptide bond的平面性質受到排列及方向的限制;既然α-碳是作為兩個胜肽平面間的轉軸點(Swivel point),故可利用C-N鍵角的旋轉-角Φ,和C-C見角的旋轉-角ψ來描述其排列方向。一般而言為了減低空間阻礙(steric hindrance)、增加相鄰原子群的穩定性,造成旋轉的角度-即相鄰平面構造的方向,所以peptide bond 上巨大的carbonyl group,其位置必須儘可能遠離相鄰的羧基及α-碳取代基。這些關係限制了相鄰碳鏈的自由度(degrees of freedom)、角Φ及ψ的旋轉。
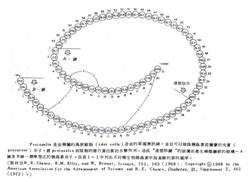
在聚肽類的結構中,氫鍵的位能也是一種重要的穩定因素。由於peptide bond使得一個peptide bond中的carbonyl group與另一個peptide bond中的醯胺基可能產生相互作用力,所以雖然氫鍵的吸引力很弱,但在聚肽鏈中因有很多可能的氫鍵發生,所以氫鍵成為使聚肽穩定的一個重要因素。具有最大氫鍵位能的兩種聚肽鏈形態,就是α-螺旋狀體(α-helix)和β-結構(β-structure)。
Pauling及Corey在1951年提出了α-螺旋狀結構為二級構造中的一種型式之假設,此種結構因為具有天生的穩定性,而在自然界中可以存在。α-螺旋狀體是一種聚肽類的旋轉排列,直鏈繞著中心的軸旋轉,每一胺基酸從螺旋中以一定形態伸出。此螺旋體每旋轉一次有3.6個胺基酸,並且螺旋上下兩層間與軸平行的距離是5.4A。由此可知每一個胺基酸會有1.5A (5.4/3.6)的上升距離。此種空間結構排列極為嚴密,使得螺旋狀結構中的氫鍵位能達到最大。
在α-螺旋狀體中,每一胺基酸carbonyl group上的氧,與同一螺旋狀體中,該前方第四個胺基酸中醯胺的氫,會產生氫鍵,氫鍵的位置幾乎是和螺旋狀體的軸是平行的。此種螺旋狀結構及由氫鍵造成的穩定效果,形成外型為圓筒狀,相當穩固,但在伸縮及彎曲時形態會有可逆性的改變。
多數的胺基酸,都可以作為α-螺旋柱結構單位,Proline是一個例外,因為它是環狀結構,所以不會在螺旋狀體中發生;具有巨大支鏈如Valine及isoleucine般的胺基酸,也會中斷阻礙螺旋狀結構。凡不能做為螺旋狀體結構單位的胺基酸,都視為螺旋狀體”破壞者”(Breakers)。
Pauling及Corey在1951年同時提出二級構造的另一種型式,稱為β-結構或摺片狀(pleated sheet)的聚肽鏈排列。在此種形態中,許多的聚肽鏈邊靠邊緊密接觸,這些鏈藉著分子內氫鍵而穩定結構。為了要增加鏈和鏈之間的最大氫鍵數目,聚肽大小必須比完全延展開來的長度略短,使得胜肽類的基幹看似皺起,其形態和摺片相似。在β結構中的支鏈位置,是在片狀的上方或下方,相鄰胺基酸的支鏈方向互不相同。在摺片狀構造中的肽鏈排列,可能是彼此同向平行,或者是反向平行。在同向平行的結構中,所有的肽鏈均是由胺基一端排列到羧基一端的相同方向,而在反向平行的結構中,相鄰各鏈的方向彼此互不相同。
四、纖維狀與球狀蛋白(Fibrous and globular proteins)
纖維狀蛋白質在某些情況下視為α-螺旋狀結構,而在其他狀況下為β-結構。如頭髮的α-角蛋白類(α-keratin)是以α-螺旋狀體為結構之外型;而β-結構則在絲的絲膠蛋白(sericin)中可以發現。纖維狀蛋白的二級構造較球狀蛋白的二級構造規則得多。典型的球狀蛋白是不能用任何單一的二級構造來描述,而要用包括α-螺旋狀體的片斷,β-結構單位,及不規則或無重複性的結構三者總和之形態描述。
闡述球狀蛋白的二級構造是一種很困難的工作,必須和研究蛋白質晶體的x-射線繞射分析合用。從1961到1963年報告中,kendrew出版的肌蛋白(myoglobin)三度空間電子密度圖(Three dimensional electron density maps)及Peruty的血紅素,為我們在瞭解蛋白質的詳細分子構造上建立了一個新的紀元。
肌肉細胞中和氧結合的蛋白質是一種單一的聚肽鏈,具有153個胺基酸,並由非共價性吸引力和一個原血紅素基(heme group)結合。Kendrew建立了這骨幹形態並且注意到佔有胺基酸總數70%的八個α-螺旋狀體部分的存在。α-螺旋狀體部分像一種穩固的圓筒結構,在空間中之結構與Pauling和Corey所提出的結構極為相似。延展型式的聚肽鏈之部分和α-螺旋狀體區域相連接,這使得整個鏈可以彎曲及旋轉。若從氮一端開始順著聚肽鏈之方向,很明顯的看出鏈會改變方向,並從前方轉到背後。整個摺疊的效應使得整個結構縮緊,並且造成橢球之形狀。
肌蛋白及血紅素較許多他種的球狀蛋白含有高量的α-螺旋狀體區域。最近在酵素上的研究,如雞的蛋白溶菌酶(egg-white lysozyme),牛的乳凝乳蛋白酶A(Bovine Chymotrpsin A),牛的核醣核酸酶(Bovine ribonuclease)及木瓜酵素(papain),顯示出螺旋狀體的量從chymotrpsin中僅數捲,到在papain中佔全部胺基酸的20%。在chymotrpsin的三度空間結構裡,聚肽鏈有很廣泛的摺疊,只有C-端八個胺基酸是α-螺旋狀體形態。聚肽鏈主要是延展的形態,鏈之區域間彼此是反向平行。Lysozyme及許多其他種類的酵素,及除了延展的鏈狀及α-螺旋狀體區域以外,具有β-結構。β-結構當存在於lysozyme中是以同向平行,但在ribonuclease及papain中卻是反向平行的結構。
3.蛋白質的三級構造(Tertiary structure of proteins)
一、高度解析X-射線結晶學(High resolution x-ray crystallograply)
二、極性與非極性胺基酸(Polar and nonpolar residues)
三、蛋白質的摺合(Folding of the protein molecule)
一、高度解析X-射線結晶學(High resolution x-ray crystallograply)
為求瞭解球狀蛋白中胺基酸的排列,必須使用具有高度解析力(1.5到2A)的x-射線繞射圖形來研究。電子密度圖代表蛋白質晶體內不同程度的單元體。這些三度空間電子密度分析和胺基酸的順序分析合用,可決定每一個組成胺基酸原子的位置。有了這些資料後,便可以建立一個三度空間結構的蛋白質分子模型。
x-射線繞射分析法進步得很快,許多不同生理功能、不同大小及不同聚肽鏈數目的蛋白質分子組成,都用這種方法分析。這些研究顯示,典型的球狀蛋白是緊密的、具有廣泛摺疊的聚肽鏈。此種分子緊密的性質,使得分子將其胺基酸支鏈都擠到彼此互相接觸的地步,接近的距離足以促進支鏈間的反應。蛋白質的三級構造,即是指在摺疊分子中支鏈的排列位置。
在極性原子群間會發生氫鍵及鹽類連接(Salt linkages);在非極性原子群間發生疏水(hydrophobic)及凡得瓦(Van der Waals)作用力,雙硫鍵即是一種特殊型式的支鏈反應,這是將兩個Cystine胺基酸連接的一種共價鍵。雖然支鏈的非共價性吸引力是一種較弱的吸引力,但由於造成此種吸力的原子群很多,所以這種吸引力成為一種重要的穩定因子,和在二級構造中的氫鍵類似,可以看出二級構造和三級構造是有很密切的關係的。
二、極性與非極性胺基酸(polar and nonpolar residues)
將胺基酸分類為極性或非極性,對於確定蛋白質結構中支鏈的功能很有幫助。以物理-化學研究為基礎,在不同溶劑中的溶解度大者,即在表面與內部胺基酸的位置,可以很容易的將胺基酸分成兩大類。極性的胺基酸也稱為親水性胺基酸,含有能夠形成氫鍵,或與合適共存者形成離子鍵的支鏈原子或官能基。在此群中的有酸性、鹼性、脂肪醇、及醯胺取代基。
非極性胺基酸則藉著脂肪族或芳香族支鏈取代基之存在與否來分辨。在水溶液環境中,這些碳氫支鏈有利於自身結合或形成疏水鍵。疏水性吸引力對於天然蛋白質的形態及穩定性有極大的貢獻。必須注意的是,有些胺基酸同時包含有極性與非極性的取代基。Tyrosine具有極性的酚基及非極性的芳香環,tryptophan具有極性的indole而其餘支鏈為非極性。Glutamic acid及lysine具有極性官能基也具有非極性的methylene,這種混合的型式,使得摺疊狀態下胺基酸間的吸引力變通性增大。
在內部極性基若有氫鍵或離子鍵的形成,穩定性會增加。球狀蛋白的二次構造包括內部α-螺旋形區域及β-結構,並在peptide bond與支鏈取代基間有氫鍵的形成。在無水的環境中,內部埋藏的離子基傾向於形成離子對。在特殊蛋白質中,所形成鍵的型式決定於胺基酸排列的順序,但一般而言,摺合的結構使得內部極性基間的吸引力達到最大。
三、蛋白質的摺合(Folding of the protein molecule)
有作用的胺基酸支鏈,在特定的形態下,有使整個大分子結構穩定的功用。我們也可以看出這些同樣的反應,可幫助聚肽鏈從不規則組合的狀態,摺合成具有生化活性標準形態之分子。
由Anfinsen及他的同事所做之一連串實驗,顯示出聚肽鏈的摺合是一種自然發生的過程,協同因子(co-factors)及酵素催化反應與其均無關係。在摺合的過程中,聚肽鏈會經歷多次形態的轉換,以達到一種具有最大穩定性的特定結構。換一句話說,也就是聚肽鏈會尋找一種具有最低自由能(free energy)的結構,顯示出聚肽鏈的一級結構順序,決定了摺合蛋白質分子的最終形態。
這些結論是從變性的核醣核酸(ribonuclease),以及其他酵素之再摺合的研究而得出的。用8M尿素(urea)及乙基硫醇(mercaptoethanol)處理核醣核酸(ribonuclease),前者作用在於使分子的摺合解開,後者造成四個雙硫鍵的還原。經過轉變的分子含有八個硫氫基(sulfhydryl group),失去生化活性;並且其物理性質也和預測的變性分子性質相符合。然後將8M尿素(urea)及乙基硫醇(mercaptoethanol)移去,置於合適的緩衝液中,在pH 8.0下進行雙硫鍵的氧化,這些狀況導致四個雙硫鍵形成,伴隨著酵素活性的恢復,而恢復蛋白質的性質和天然分子的性質相似;由於活性分子的生成量很高,表示平衡是有利於摺合狀態的。
需要注意的是8個硫氫基(sulfhydryl group)有105種形成雙硫鍵的方法,若polypeptide的摺合是一種隨機過程,則會形成105種不同結構,最多只有百分之一的機會形成正確的核醣核酸酶。而觀察到的生成量卻很高,並且再生的核醣核酸酶中雙硫鍵之正確配對,顯示只有一種組合狀態是有利的。因此蛋白質中胺基酸順序指導其分子的三度空間結構,同時可假設這些實驗觀察,也適用於蛋白質分子生物合成相關的摺合過程。
※ 參考資料: 王立禾, 阮立昂譯 蛋白質構造與功能 P6~14 復漢出版社 (1977)